题目内容
(第1小题1分,其余每空2分,共11 分)
短周期元素A、B、C、D中,0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4 g A的氧化物恰好与100 mL 0.2 mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素是第二周期中原子半径最小的元素,C2-比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)B元素的名称是 。
(2)画出D和C2-的结构示意图 。______________________。
(3)将B元素形成的单质通入水中反应的化学方程式为_________________________, B、C、D三种元素形成的氢化物中稳定性最强的是_______(填写化学式,下同),最高价氧化物的水化物酸性最强的是_______。
(1)氟;(2)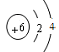 ;
;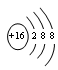 (3)2F2 +2H2O ="=" 4HF +O2, HF, H2SO4。
(3)2F2 +2H2O ="=" 4HF +O2, HF, H2SO4。
解析试题分析:根据题意可知:A是Mg元素,B是F元素;C是S元素,D是C元素。(1)B元素的名称是氟;(2)画D的结构示意图是: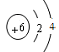 ;C2-的结构示意图是
;C2-的结构示意图是 ;(3)将B元素形成的单质通入水中反应的化学方程式为2F2 +2H2O ="=" 4HF +O2,B、C、D三种元素中非金属性最强的是F元素,元素的非金属性越强,其形成的氢化物的稳定性就越强,所以最稳定的氢化物是HF;由于F的非金属性在所有元素中最强,不能形成含氧酸,所以除此以外,非金属性最强的是S原子,S的最高价氧化物的水化物酸性最强,是H2SO4。
;(3)将B元素形成的单质通入水中反应的化学方程式为2F2 +2H2O ="=" 4HF +O2,B、C、D三种元素中非金属性最强的是F元素,元素的非金属性越强,其形成的氢化物的稳定性就越强,所以最稳定的氢化物是HF;由于F的非金属性在所有元素中最强,不能形成含氧酸,所以除此以外,非金属性最强的是S原子,S的最高价氧化物的水化物酸性最强,是H2SO4。
考点:考查元素的推断、元素的名称、离子、原子结构示意图、化学方程式及物质的稳定性、酸性强弱比较的知识。

 黄冈创优卷系列答案
黄冈创优卷系列答案下列提出原子学说的科学家是( )
| A.拉瓦锡 | B.道尔顿 | C.门捷列夫 | D.波义耳 |
下列分子中所有原子都满足最外层为8电子结构的是( )
| A.CS2 | B.PCl5 | C.HClO | D.BeCl2 |
(8分每空1分)
(1)下列3种不同粒子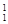 H、
H、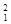 H、
H、 H表示______种元素,______种核素,
H表示______种元素,______种核素,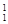 H、
H、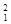 H、
H、 H互称为__________________。
H互称为__________________。
(2)下列各组物质中,互称为同分异构体的是( )
| A.水与冰 | B.O2与O3 |
C.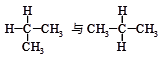 | D. |
(3)K2O: ;(4)CO2: 。
(4分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| | | | |||||
| | | | a | | | | |
| | b | | c | | | d | |
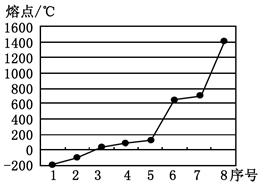
(1)元素b的基态原子电子排布式为 。
(2)第三周期8种元素按单质熔点高低的排列顺序如右图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。
(3)元素a、c分别与元素d形成的化合物中,熔点较高的是(填化学式)。
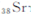 )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
 同属于第ⅡA族?
同属于第ⅡA族?