题目内容
(8分每空1分)
(1)下列3种不同粒子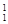 H、
H、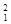 H、
H、 H表示______种元素,______种核素,
H表示______种元素,______种核素,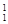 H、
H、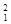 H、
H、 H互称为__________________。
H互称为__________________。
(2)下列各组物质中,互称为同分异构体的是( )
| A.水与冰 | B.O2与O3 |
C.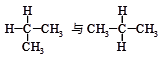 | D. |
(3)K2O: ;(4)CO2: 。
(1)1 3 同位素 (2)D (3)、(1)  (2)
(2)  (3)
(3) 
(4) 
解析试题分析:(1)具有一定数目的质子和一定数目的中子的原子就是核素,质子数相同而中子数不同的原子总成元素,质子数相同而中子数不同的原子互称同位素。3种不同粒子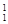 H、
H、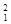 H、
H、 H表示一种元素;三种核素,它们互称同位素;(2)同分异构体是有相同的分子式而具有不同的结构的化合物。符合题意的是D;(3)OH—的电子式:
H表示一种元素;三种核素,它们互称同位素;(2)同分异构体是有相同的分子式而具有不同的结构的化合物。符合题意的是D;(3)OH—的电子式: ;N2的电子式:
;N2的电子式: ;K2O的电子式:
;K2O的电子式: ;CO2的电子式:
;CO2的电子式: 。
。
考点:考查同位素、同素异形体、核素、元素、及物质的电子式的书写的知识。

练习册系列答案
相关题目
元素性质呈现周期性变化的基本原因是
| A.元素的原子量逐渐增大 | B.核外电子排布呈周期性变化 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |
1898年,IUPAC(International Union of Pure and Applied Chemistry,国际纯粹与应用化学联合会)建议用1~18列代替原周期表中主族、副族序号,请问原第IVA族应该在第几列?
| A.第4列 | B.第14列 |
| C.第5列 | D.第15列 |
(10分)A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
| A | | C |
| | B | |
(1)A、B、C三种元素的名称分别为 、 、 。
(2)B位于元素周期表中第 周期、第 族。
(3)C的原子结构示意图为 ,C的单质与
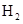 反应的化学方
反应的化学方 程式为 。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式 。
(10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是_____________;写出它的氧化物与氢氧化钠反应的离子方程式____________________________________________。
(4)用电子式表示元素④与⑥形成的的化合物的形成过程_________________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为______________________ ,该化合物是由___________ (填“极性”“非极性”)键形成的。
(10分).
Ⅰ. 下表列出了A~R 9种元素在周期表中的位置(填元素符号):
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | E | | F | | |
| 3 | A | C | D | | | | G | R |
| 4 | B | | | | | | H | |
(2) A、B、C三种元素按原子半径由大到小的顺序排列为
(3) F元素氢化物的化学式是
(4) G元素跟B元素形成化合物的电子式是
(5) G元素和H元素两者核电荷数之差是
Ⅱ 根据原子结构的有关知识和元素周期律。思考并回答有关114号元素的几个问题。
原子核外有_____个电子层,最外层电子数可能是__________
周期表中位于__________周期,________族
(3) 属于_________元素(填金属或非金属)