题目内容
(10分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为m/2-n。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构 模型如下图所示, 丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为 。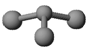
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式) 。
(5)写出B与D在高温下完全反应后生成物的电子式___ __ ,结构式___
(10分)(1) 第二周期VIA族(2分)
(2)Na2O+H2O=2Na++2OH?或2Na2O2+2H2O=4Na++4OH?+O2↑ (2分)
(3)+1(1分),NH3(1分)
(4)H2O>H2Se>H2S(2分)
(5)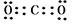 (1分),O=C=O(1分)
(1分),O=C=O(1分)
解析试题分析:(1)B原子的最外层电子数是其次外层电子数的2倍,所以B的次外层也是第一层有2个电子,最外层有4个电子,所以B是C元素;A的一种原子中,质量数与质子数之差为零,说明质量数等于质子数,只有H元素中的11H符合,所以A是H元素;D元素的原子最外层电子数为m,次外层电子数为n,;E元素的原子L层电子数为m+n,M层电子数为m/2-n,说明 E的M层电子数不为0,则 E有3个电子层,所以L层有8个电子,m+n=8,n<8,n又是D的次外层电子数,所以D的次外层只能是2,n=2,则m=6,所以D是O元素,E是Na元素。D在元素周期表中的位置是第二周期VIA族;
(2)D与E形成的化合物可以是氧化钠,也可以是过氧化钠,都与水反应,离子方程式为Na2O+H2O=2Na++2OH?或2Na2O2+2H2O=4Na++4OH?+O2↑;
(3)由甲的结构模型判断,甲是NCl3,N的电负性大于Cl,所以甲中Cl元素的化合价是+1价;与水反应生成有漂白性的化合物是HClO,所以丙是HClO,丁与H2O有相同的电子总数,则丁是NH3;
(4)D是O元素,上下相邻的同族元素有S、Se,形成的氢化物中,只有H2O分子间可以形成氢键,沸点最高,其余两种随相对分子质量的增大沸点升高,所以三种元素氢化物沸点由大到小的顺序是H2O>H2Se>H2S;
(5)C与氧气在高温下完全反应生成二氧化碳,是共价化合物,电子式为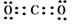 ,
,
结构式为O=C=O。
考点:考查元素的推断,元素周期律的应用,元素化合物性质的应用

 名校课堂系列答案
名校课堂系列答案下列各组性质比较中,正确的是
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③非金属性:F>C>O ④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物沸点:HF>HCl
| A.①②③ | B.②③④ | C.①②⑤ | D.①②④⑤ |
短周期元素ZW的某种微粒的结构示意图如下,下列说法一定不正确的是( )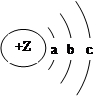
| A.Z=a+b+c | B.若Z<a+b+c,该微粒一定是原子 |
| C.c≤b=8 | D.若c=b,该微粒可能原子或阴离子 |
目前,医疗上使用放射性核素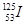 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
| A. 125 | B.72 | C.19 | D.53 |
(12分)有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下:
| 元素编号 | 特征信息 |
| A | 其中一种原子核内只有质子没有中子 |
| B | 其原子的L层电子数是K层的3倍 |
| C | 其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
| D | 其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
| E | 单质为黄绿色气体,可用于制造漂白粉 |
(1)由A、B、C三种元素形成的化合物含有的化学键类型是 。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程
式 。
(3)D单质与由A、B、C三种元素形成的化合物的水溶液反应的离子方程式
。
(4)写出实验室用软锰矿(MnO2)制取E的化学方程式 。
(5)C和D两元素形成的单质活泼些较强的是 (写元素符号),判断依据是 。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 ,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式: 。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
[Mn(H2O)6]2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为
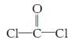 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。