题目内容
18.合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g)已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
| A. |  | B. |  | C. |  | D. | 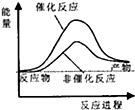 |
分析 根据△H=反应物的键能之和-生成物的键能之和,△H>0吸热,反应物的能量之和小于生成物的能量之和,△H<0放热,反应物的能量之和大于生成物的能量之和,据此分析.
解答 解:由CH4(g)+2H2O(g)?CO2(g)+4H2(g)△H=反应物的键能之和-生成物的键能之和=414×4+4×464-803×2-4×436=+162kJ/mol,所以该反应为吸热反应,则反应物的能量之和小于生成物的能量之和,又催化剂降低活化能使反应速率加快,则B正确;
故选:B.
点评 本题考查了化学反应能量变化分析,图象分析方法和应用,注意,△H>0吸热,反应物的能量之和小于生成物的能量之和,△H<0放热,反应物的能量之和大于生成物的能量之和,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列反应中,离子方程式为H++OH-=H2O的是( )
| A. | CH3COOH+NaOH═CH3COONa+H2O | B. | HNO3+KOH═KNO3+H2O | ||
| C. | 3HCl+Fe(OH)3═FeCl3+3H2O | D. | 2HCl+Cu(OH)2═CuCl2+2H2O |
20.NaHSO4在水溶液中能够电离出H+、Na+、和SO42-.下列对于NaHSO4的分类中不正确的是( )
| A. | NaHSO4是硫酸盐 | B. | NaHSO4是酸式盐 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸 |
13.现有FeCl3、CuCl2、MgSO4、K2CO3四种盐的溶液,只用一种试剂便可鉴别,这种试剂可能是下列的( )
| A. | Ba(OH)2溶液 | B. | NaOH溶液 | C. | KNO3溶液 | D. | AgNO3溶液 |
10.下列描述或说法正确的是( )
| A. | 已知常温下AgCl的溶解度远大于AgBr,现将AgCl和AgBr的两种饱和溶液等体积混合后,再加入足量浓AgNO3溶液,生成的AgCl沉淀多于AgBr沉淀 | |
| B. | Fe(OH)3溶于氢碘酸的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 甲基橙呈黄色的溶液中,I-、Cl-、NO3-、Na+一定可以大量共存 | |
| D. | 已知甲烷的燃烧热为890.3kJ•mol-1,则表示甲烷燃烧热的热化学方程式为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 |
7.如表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下列化合物与氯化氢加成时,取代基对速率的影响与表中规律类似,其中反应速率最快的是A(填序号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3 C.CH2=CH CH3 D.CH2=CHCl
该物质的名称为2,3-二甲基-2-丁烯
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:CH2=CHCH3+HBr→CH3CHBrCH3(主要产物)+CH3CH2Br(次要产物)
请写出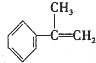 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式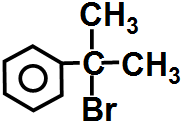 .
.
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3 C.CH2=CH CH3 D.CH2=CHCl
该物质的名称为2,3-二甲基-2-丁烯
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:CH2=CHCH3+HBr→CH3CHBrCH3(主要产物)+CH3CH2Br(次要产物)
请写出
 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式 .
. 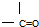 ②
②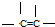 ③
③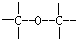 ④
④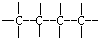
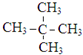
 .
.