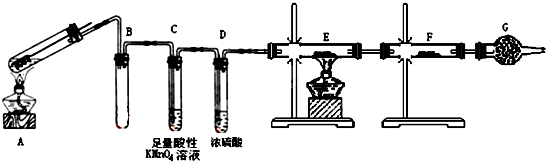
题目内容
7.如表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH2CH3 C.CH2=CH CH3 D.CH2=CHCl
该物质的名称为2,3-二甲基-2-丁烯
(2)烯烃与溴化氢、水加成时,产物有主次之分,例如:CH2=CHCH3+HBr→CH3CHBrCH3(主要产物)+CH3CH2Br(次要产物)
请写出
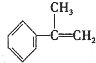 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式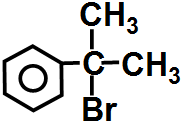 .
.
分析 有机物的结构决定其性质,分析表中数据可以看出,当乙烯分子中的H原子被甲基取代时,反应速率加快,且甲基个数越多,反应速率越快;当乙烯分子中的H原子被卤原子取代时,反应速率减慢,以此解答该题.
解答 解:(1)分析表中数据可知,反应速率与C=C中烃基的个数有关,烃基越多,反应速率越大,并且当C=C上取代基为卤素原子的反应速率慢,卤素原子越多反应速率越慢,由于(CH3)2C=C(CH3)2的烃基最长,且不含卤素原子,反应最快,此烃为烯烃,最长碳链为4,在2、3号碳之间含有1个碳碳双键,在23号碳上分别含有1个甲基,正确命名为:2,3-二甲基-2-丁烯,故答案为:A;2,3-二甲基-2-丁烯;
(2)由所给信息:CH2=CHCH3+HBr→CH3CHBrCH3(主要产物)+CH3CH2Br(次要产物),Br加在中间碳山为主要产物,加在端点碳上为次要产物,那么 的主要加成产物为:
的主要加成产物为: ,故答案为:
,故答案为: .
.
点评 本题综合有机化学知识和化学反应速率知识,通过分析数据总结出规律,再用此规律解决问题,这是本题最大的特点,本题综合考查了重要的烃和烃的含氧衍生物的性质、相互转化关系.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
8.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 46gNO2和 N2O4混合气体中含有原子总数为3NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | 7.1k氯气与足量NaOH溶液反应转移的电子数为0.2NA. | |
| D. | 1molC10H22分子中共价键总数为62 NA |
18.合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g)
已知,破坏1mol化学键需要吸收的热量如下表所示:
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是( )
已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
| A. | 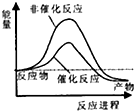 | B. | 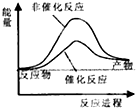 | C. | 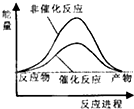 | D. | 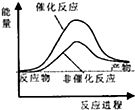 |
15.硒是第四周期ⅥA元素,现在含有元素硒(Se)的保健品已经进入市场,关于硒的说法中不正确的是( )
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | Se氧化物化学式有:SeO2、SeO3 |
2.下列关于化学键的说法正确的是( )
| A. | 离子化合物中一定存在离子键,可能存在共价键 | |
| B. | 由金属元素和非金属元素组成的化学键一定是共价键 | |
| C. | 非极性键只存在于双原子单质分子中 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 室温下,22.0g C18O2气体中含有的碳原子数目为0.5NA | |
| B. | 1mol OH-中电子数为10NA | |
| C. | 标准状况下,22.4L乙醇中含有的氧原子数为1.0NA | |
| D. | 1mol C2Cl6分子含有7 NA个共价键 |
16.关于烃和甲烷的叙述不正确的是( )
| A. | 烃的组成均符合通式CnH2n+2 | |
| B. | 烃类均不溶于水 | |
| C. | 甲烷在烃中含碳量最低 | |
| D. | 甲烷只能发生取代反应而不能发生加成反应 |
17.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,2.24 L苯中含有的分子数为0.1 NA | |
| B. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1 NA | |
| C. | 0.1 mol•L-1的硫酸铜溶液中含铜离子数为0.1 NA | |
| D. | 1mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |