题目内容
20.NaHSO4在水溶液中能够电离出H+、Na+、和SO42-.下列对于NaHSO4的分类中不正确的是( )| A. | NaHSO4是硫酸盐 | B. | NaHSO4是酸式盐 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸 |
分析 根据物质的分类进行区分,在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸,同时含有金属离子(或铵根)和酸根的化合物叫做盐.可根据阳离子对盐进行分类,酸式盐既能电离出氢离子,又能电离出金属阳离子或铵根离子,以此进行分类.
解答 解:NaHSO4在水溶液中电离出H+、Na+、和SO42-,含有酸根离子、金属阳离子和氢离子,属于盐中的酸式盐、硫酸盐,
从阳离子的分类可看成钠盐,而在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸,所以D不正确,
故选D.
点评 本题考查物质的分类,题目难度不大,注意盐的分类方法和角度.

练习册系列答案
相关题目
10.下列反应中,既属于氧化还原反应,同时又是吸热反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | 铝与盐酸的反应 | ||
| C. | 强酸和强碱反应生成水的反应 | D. | 灼热的炭与二氧化碳的反应 |
8.设NA为阿佛加德罗常数,下列叙述中正确的是( )
| A. | 46gNO2和 N2O4混合气体中含有原子总数为3NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | 7.1k氯气与足量NaOH溶液反应转移的电子数为0.2NA. | |
| D. | 1molC10H22分子中共价键总数为62 NA |
15.下列离子方程式书写正确的是( )
| A. | 钠投入CuSO4溶液中:2Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ | |
| B. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
5.下列各组中的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 沸点:H2O>HF>HCl>HBr | ||
| C. | 非金属性:F>O>S | D. | 稳定性:PH3<H2S<HCl |
1.下列说法正确的是( )
| A. | 化学反应中的能量变化,都表现为热量的变化 | |
| B. | 熔融态导电的一定是离子化合物 | |
| C. | 构成单质分子的微粒中一定含有化学键 | |
| D. | 是吸收能量的反应还是释放能量的反应,必须看反应物的总能量和生成物的总能量的相对大小 |
18.合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g)
已知,破坏1mol化学键需要吸收的热量如下表所示:
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是( )
已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
| A. |  | B. |  | C. |  | D. | 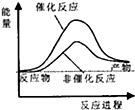 |