题目内容
6.有效地利用现有新能源和开发新能源已受到各国的重视.(1)可用改进汽油组成的办法来改善汽油的燃烧性能.例如,加入CH3OC(CH3)3来生产“无铅汽油”H3COC(CH3)3分子必存在的原子间连接形式有③.(填写编号,多选倒扣分)
①
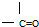 ②
②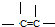 ③
③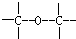 ④
④
(2)天然气的燃烧产物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一,天然气常和石油伴生,其主要的成分是甲烷.能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)
①其一氯取代物不存在同分异构体 ②其二氯取代物不存在同分异构体
(3)写出符合下列条件的有机物的结构简式
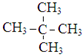
A.甲烷的同系物 B.氢原子数为十二 C.一氯取代物只有一种结构
(4)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4的燃烧热化学方程式是N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-624kJ/mol.
(5)用(4)的反应设计原电池,用铂做电极,电解质溶液是20%的KOH溶液.则电池放电时负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑,当负极消耗16.0g还原剂时,则正极消耗的氧化剂在标况下的体积为11.2L.
分析 (1)碳原子最多形成四个单键,氧原子最多形成两个;
(2)甲烷是正四面体结构,四个氢原子完全等效;
(3)根据烷烃的通式可知,2n+2=12,n=5,则烷烃为戊烷,有正戊烷、异戊烷、新戊烷三种同分异构体;一氯取代物只有一种结构,说明戊烷只有一种氢原子;
(4)根据肼和反应热的关系计算出其燃烧热,并写出其相应的热化学方程式;
(5)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应;根据反应方程式计算需要空气的体积.
解答 解:(1)根据碳的四价键结构、氧的二价键架构,结合该分子有支链,可知在CH3OC(CH3)3分子中必然存在的原子间连接形式有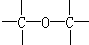 ,故答案为:③;
,故答案为:③;
(2)天然气的主要成分是甲烷,根据分子式,可推测CH4的空间结构只有平面正方形和正四面体两种可能.若为平面正方形结构,则其二元取代物有两种同分异构体,而正四面体的二元取代物不存在同分异构体;故答案为:甲烷(或者CH4);②;
(3)根据烷烃的通式可知,2n+2=12,n=5,则烷烃为戊烷,有正戊烷、异戊烷、新戊烷三种同分异构体;一氯取代物只有一种结构,说明戊烷只有一种氢原子,该戊烷为新戊烷,结构简式为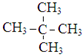 ,故答案为:
,故答案为: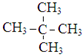 ;
;
(4)32.0g肼的物质的量为1mol,1molN2H4在氧气中完全燃烧生成氮气放出热量624kJ,所以其热化学反应方程式为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol,
故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-624KJ/mol;
(5)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,
当负极消耗16.0g还原剂时,设消耗的氧化剂在标况下的体积为X.
N2H4(l)+O2(g)=N2(g)+2H2O(l)
28 22.4L
16.0g X
$\frac{28}{16.0g}$=$\frac{22.4L}{X}$
解得X=11.2L,
故答案为:N2H4+4OH--4e-=4H2O+N2↑;11.2L.
点评 本题考查了有机物、盖斯定律、原电池原理,明确原电池原理是解题的关键,难度中等.

 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案| A. | 一部分为A1(OH)3,一部分为Al3+ | B. | 一部分为Al(OH)3,一部分为A1O2- | ||
| C. | 全部是Al(OH)3 | D. | 全部是A1O2- |
| A. | 46gNO2和 N2O4混合气体中含有原子总数为3NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | 7.1k氯气与足量NaOH溶液反应转移的电子数为0.2NA. | |
| D. | 1molC10H22分子中共价键总数为62 NA |
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 沸点:H2O>HF>HCl>HBr | ||
| C. | 非金属性:F>O>S | D. | 稳定性:PH3<H2S<HCl |
| A. | 化学反应中的能量变化,都表现为热量的变化 | |
| B. | 熔融态导电的一定是离子化合物 | |
| C. | 构成单质分子的微粒中一定含有化学键 | |
| D. | 是吸收能量的反应还是释放能量的反应,必须看反应物的总能量和生成物的总能量的相对大小 |
已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
| A. | 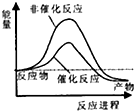 | B. | 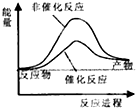 | C. | 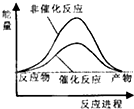 | D. | 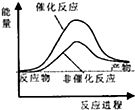 |
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | Se氧化物化学式有:SeO2、SeO3 |
| A. | 烃的组成均符合通式CnH2n+2 | |
| B. | 烃类均不溶于水 | |
| C. | 甲烷在烃中含碳量最低 | |
| D. | 甲烷只能发生取代反应而不能发生加成反应 |