题目内容
13.现有FeCl3、CuCl2、MgSO4、K2CO3四种盐的溶液,只用一种试剂便可鉴别,这种试剂可能是下列的( )| A. | Ba(OH)2溶液 | B. | NaOH溶液 | C. | KNO3溶液 | D. | AgNO3溶液 |
分析 四种物质含有的阳离子各不相同,可加入NaOH溶液检验,生成物的现象各不相同,以此解答该题.
解答 解:A.MgSO4、K2CO3与Ba(OH)2溶液反应均生成白色沉淀,现象相同,不能鉴别,故A错误;
B.加入NaOH溶液,则MgSO4生成白色沉淀,CuCl2生成蓝色沉淀,FeCl3生成红棕色沉淀,与K2CO3不反应,可鉴别,故B正确;
C.均不与硝酸钾反应,不能鉴别,故C错误;
D.均与硝酸银反应生成白色沉淀,不能鉴别,故D错误;
故选B.
点评 本题考查物质的检验和鉴别,为高频考点,注意把握物质的性质的异同为解答该题的关键,学习中注意积累,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列说法正确的是( )
| A. | 将CO2通入溶有足量氨气的BaCl2溶液中,无白色沉淀生成 | |
| B. | 将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色 | |
| C. | 石蕊试纸和pH试纸使用前都必须用蒸馏水润湿 | |
| D. | 浓硫酸有氧化性,稀硫酸没有氧化性 |
15.下列离子方程式书写正确的是( )
| A. | 钠投入CuSO4溶液中:2Na+Cu2++2H2O═2Na++Cu(OH)2↓+H2↑ | |
| B. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 铁和稀HNO3反应后,溶液pH=2:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O |
1.下列说法正确的是( )
| A. | 化学反应中的能量变化,都表现为热量的变化 | |
| B. | 熔融态导电的一定是离子化合物 | |
| C. | 构成单质分子的微粒中一定含有化学键 | |
| D. | 是吸收能量的反应还是释放能量的反应,必须看反应物的总能量和生成物的总能量的相对大小 |
18.合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)?CO2(g)+4H2(g)
已知,破坏1mol化学键需要吸收的热量如下表所示:
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是( )
已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
| A. | 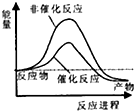 | B. | 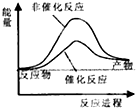 | C. | 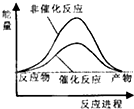 | D. | 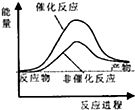 |
2.下列关于化学键的说法正确的是( )
| A. | 离子化合物中一定存在离子键,可能存在共价键 | |
| B. | 由金属元素和非金属元素组成的化学键一定是共价键 | |
| C. | 非极性键只存在于双原子单质分子中 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
3.下列实验不能达到目的是( )
| A. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 | |
| B. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| C. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 | |
| D. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了反应而成碱性 |
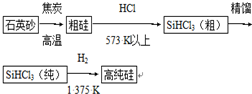
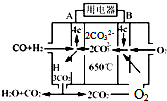 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.