题目内容
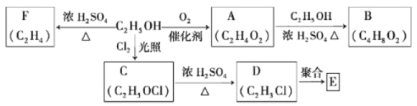
【题目】一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2![]() CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
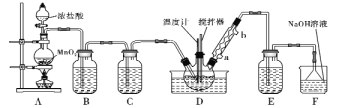
(1)A装置中的离子反应方程式为 ________________________________________________。
(2)一氯化硫(S2Cl2)常温下为液态,较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式:____________________________。
(3)C、E装置中所盛溶液为__________。
(4)D中冷凝管的冷水进水口为____(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是________。
【答案】MnO2+ 2Cl-+4H+ ![]() Mn2++Cl2↑+2H2O 2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑ 浓硫酸 a 赶走装置内部的氧气和水,避免S2Cl2因反应而消耗
Mn2++Cl2↑+2H2O 2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑ 浓硫酸 a 赶走装置内部的氧气和水,避免S2Cl2因反应而消耗
【解析】
从装置图中可以看出,A为氯气的制取装置,B为除去氯气中氯化氢的装置,C为干燥氯气的装置,D为制取一氯化硫的装置,E为干燥装置,F为尾气处理装置,据此分析解答问题。
(1)A装置为实验室制取Cl2的装置,发生反应的离子反应方程式为MnO2+ 2Cl-+4H+ ![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+ 2Cl-+4H+
Mn2++Cl2↑+2H2O,故答案为:MnO2+ 2Cl-+4H+ ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)一氯化硫(S2Cl2)常温下较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体(S),而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl,说明两种气体为HCl和SO2。一氯化硫与水反应的化学反应方程式2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,故答案为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(3)一氧化硫遇水即歧化,所以C、E装置均起干燥作用,可盛放浓硫酸,故答案为:浓硫酸;
(4)冷凝管的冷却水流向都是下进上出,所以D中冷水进水口为a;因为一氯化硫易被氧化,且遇水即歧化,所以实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是赶走装置内部的氧气和水,避免S2Cl2因反应而消耗,故答案为:a;赶走装置内部的氧气和水,避免S2Cl2因反应而消耗。

【题目】如何降低大气中CO2的含量及有效地开发利用碳资源的研究越来越紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
如表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H ________0 ( 填“>”、 “ < “ 或 “ = ”) ;
②判断反应达到平衡状态的依据是________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
③借助上表数据判断,要提高CO的转化率,可采取的措施是________.
A.升温 B.充入更多H2 C.分离出甲醇 D.加入催化剂
(2)CH3OH可以用做燃料电池的燃料,以甲醇与氧气的反应为原理设计,现有电解质溶液是KOH溶液的燃料电池。请写出该电池负极的电极反应式:____________________.
(3)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=________________。