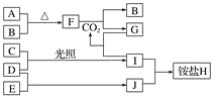
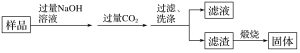
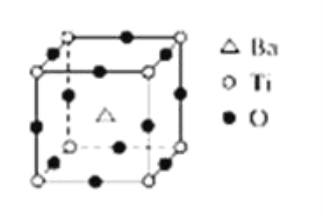
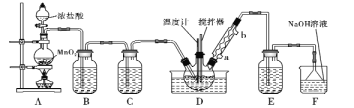
题目内容
【题目】某溶液中可能含有H+、NH![]() 、Mg2+、Al3+、Fe3+、CO
、Mg2+、Al3+、Fe3+、CO![]() 、SO
、SO![]() 、NO
、NO![]() 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。
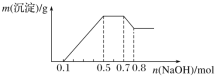
则下列说法正确的是( )
A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中一定不含CO![]() ,可能含有SO
,可能含有SO![]() 和NO
和NO![]()
C.溶液中n(NH![]() )=0.2 mol
)=0.2 mol
D.n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1
【答案】C
【解析】
若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32-和NO3-不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42-,结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(NH4+),据此解答。
若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则CO32和NO3不能大量共存;
加入NaOH溶液,产生白色沉淀,说明不存在Fe3+,根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续进入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+,由于溶液中还必须存在阴离子,所以一定还有SO42;由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol0.5mol=0.2mol,则n(NH4+)=0.2mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;
第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol0.1mol=0.4mol,则n(Mg2+)=![]() =0.05mol,
=0.05mol,
A. 由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、NH4+,故A错误;
B.由上述分析可知,溶液中一定不含CO32、NO3,一定含有SO42,故B错误;
C. 由上述分析可知,溶液中n(NH4+)=0.2mol,故C正确;
D. 由上述分析可知,溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D错误;
答案选C。