题目内容
【题目】如何降低大气中CO2的含量及有效地开发利用碳资源的研究越来越紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H
CH3OH(g) △H
如表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H ________0 ( 填“>”、 “ < “ 或 “ = ”) ;
②判断反应达到平衡状态的依据是________.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
③借助上表数据判断,要提高CO的转化率,可采取的措施是________.
A.升温 B.充入更多H2 C.分离出甲醇 D.加入催化剂
(2)CH3OH可以用做燃料电池的燃料,以甲醇与氧气的反应为原理设计,现有电解质溶液是KOH溶液的燃料电池。请写出该电池负极的电极反应式:____________________.
(3)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)BaCO3(s)+SO42-(aq)。已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=________________。
【答案】< BD BC CH3OH+8OH-6e-=CO32-+6H2O 2.5×10-9
【解析】
(1)①由表中数据可知,随着温度的升高,平衡常数减小,说明平衡逆向移动,正反应是放热反应,则ΔH<0,故答案为:<;
②A.生成CH3OH的速率与消耗CO的速率相等均表示正反应速率,不能说明反应达到平衡状态,A错误;
B.混合气体的质量始终不变,建立平衡的过程中混合气的物质的量减小,混合气的平均相对分子质量增大,所以混合气体的平均相对分子质量不变可以说明反应达到平衡状态,B正确;
C.混合气体的质量始终不变,容积不变,则混合气体的密度始终不变,混合气体的密度不变不能说明反应达到平衡状态,C错误;
D.CH3OH、CO、H2的浓度都不再发生变化说明反应达到平衡状态,D正确;
故答案选BD;
③根据表中数据可知随着温度的升高,平衡常数减小,这说明正反应是放热反应。又因为正反应是体积减小的可逆反应,则要提高CO的转化率:
A.升高温度平衡向逆反应方向进行,CO转化率降低,A不符合题意;
B.充入氢气,平衡正向进行,CO转化率增大,B符合题意;
C.分离出甲醇,平衡正向进行,CO转化率增大,C符合题意;
D.加入催化剂不能改变平衡状态,CO的转化率不变,D不符合题意;
故答案选BC;
(2)碱性条件下,CH3OH作燃料电池的负极,发生氧化反应,失去电子变成CO32-,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)根据方程式可知该反应的平衡常数K=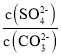 =
=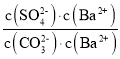 =
=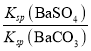 =4.0×10-2,所以BaCO3的溶度积Ksp=
=4.0×10-2,所以BaCO3的溶度积Ksp=![]() =2.5×10-9,故答案为:2.5×10-9。
=2.5×10-9,故答案为:2.5×10-9。

 名校课堂系列答案
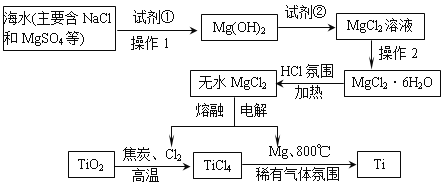
名校课堂系列答案【题目】目前世界上60%的镁是从海水中提取的,从海水中提取的MgCl2制得Mg和Cl2,进一步联合用金红石(主要成分TiO2)冶炼金属钛,工业上其主要的生产流程如下:
|
回答下列问题:
(1)加入过量试剂①后,能够分离得到Mg(OH)2沉淀的方法操作1用到的玻璃仪器有________________________________________;试剂②可以选用______。
(2)要得到MgCl2·6H2O的操作2名称是___________________________________。
(3)工业上冶炼金属钛的上述生产流程,其第1步是在高温下向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体,写出这步反应的化学方程式:____________________________。
(4) 工业上冶炼金属钛的上述生产流程,其第2步是在稀有气体氛围和加热的条件下,用镁与TiCl4反应得到钛,写出这步反应的化学方程式____________________,该反应时稀有气体氛围的作用是_____________________________________,该反应的金属冶炼方法属于是____________________。
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
A | |||||||||
C | D | ||||||||
B | E | F | |||||||
(1)画出D的原子结构示意图________ ;
(2)A和F两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。;
(3)E和F分别形成的气态氢化物中最稳定的是_________(填写氢化物的化学式)
(4)B的最高价氧化物的水化物的化学式_____________。