题目内容
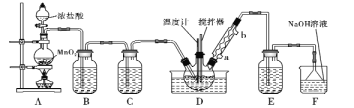
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
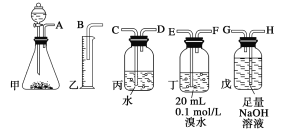
(1)进行实验时,所制气体从左向右流,仪器的正确连接顺序是________________(填接口字母);
(2)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用__________;
(3)若没有除H2S的装置,测定结果将会__________(填“偏高”、“偏低”或“不变”),理由是________________________。
【答案】AHGEFDCB 饱和食盐水 偏高 H2S+Br2=S↓+2HBr
【解析】
(1)电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积;
(2)实验室一般用饱和食盐水代替水进行实验,以获得平稳的乙炔气流;
(3)硫化氢具有还原性,能够与溴发生氧化还原反应,导致测得乙炔的物质的量偏多。
(1)电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积,所制气体从左向右流,仪器的正确连接顺序是:AHGEFDCB;
故答案为:AHGEFDCB;
(2)为了使实验中气流平稳,实验室一般用饱和食盐水代替水进行实验;
故答案为:饱和食盐水;
(3)硫化氢具有还原性,能够与溴发生氧化还原反应,导致测得乙炔的物质的量偏多,最终测得电石的纯度偏高,发生H2S+Br2=S↓+2HBr,故答案为:偏高;H2S+Br2=S↓+2HBr。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:
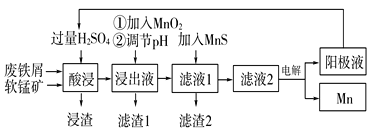
已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是____。
(2)流程图中“①加入MnO2”的作用____,MnO2还可以用其他试剂____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是___~7.6。上述流程中,能循环使用的一种物质是___(填化学式)。
(4)向滤液Ⅰ中加入MnS的作用是除去Co2+、Ni2+等离子,其中可以发生反应为MnS(s)+Ni2+(aq)=NiS(s)+Mn2+(aq)等。当该反应完全后,滤液2中的Mn2+与Ni2+的物质的量浓度之比是___[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)在适当条件下,在MnSO4、H2SO4和H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为____。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
【题目】在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
A | |||||||||
C | D | ||||||||
B | E | F | |||||||
(1)画出D的原子结构示意图________ ;
(2)A和F两种元素组成的化合物中含有的化学键是_____(填“共价”或“离子”)键。;
(3)E和F分别形成的气态氢化物中最稳定的是_________(填写氢化物的化学式)
(4)B的最高价氧化物的水化物的化学式_____________。