��Ŀ����
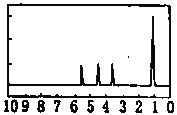
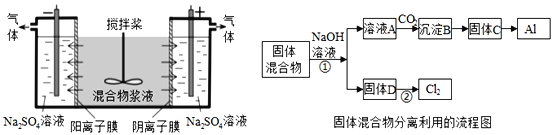
����Ŀ��ij����ャҺ����Al(OH)3��MnO2������Na2CrO4�����ǵ��������������ʹNa2CrO4������ȫ��ˮ������ij�о�С��������Ƶĵ�����װ�ã���ͼ����ʹ��Һ����ɹ�������ͺ���Ԫ����Һ�����������á��ش��������е����⡣
![]()
������������ķ�������ã�����ͼ�еIJ��ַ�������ͷ�Ӧ����δ������
��1��C��Al���Ʊ�������Ϊ��ⷨ����д��������Ӧ����ʽ_____________________��
��2����С��̽����Ӧ��������������D��Ũ�����ϣ��������ޱ仯��������Cl2���ɣ�����Ӧֹͣ������ʣ�࣬��ʱ�μ����ᣬ�ֲ���Cl2���ɴ��ж�Ӱ��÷�Ӧ��Ч���е������У�����ţ�_____��
A���¶� B����Һ��pHֵ C��Cl-��![]() -��Ũ��
-��Ũ��
��3������D�Ǽ���п�̵�ص���������д���õ�صĸ�����Ӧ����ʽ_____________ ��
��4��0.2molCl2�뽹̿��TiO2��ȫ��Ӧ������CO��TiCl4���۵�-25��,�е�136��4��������8.56kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ______________________________________��
��������Ԫ����Һ�ķ��������
��5���ö��Ե缫���ʱ��![]() �ܴӽ�Һ�з��������ԭ����_________________��
�ܴӽ�Һ�з��������ԭ����_________________��
�����õ��ĺ���Ԫ�ص�������![]() ����
����![]() ����ԭ����__________________________(�����ӷ�Ӧ����ʽ��ʾ)�����������ɵ�����Ϊ_____________��д��ѧʽ����
����ԭ����__________________________(�����ӷ�Ӧ����ʽ��ʾ)�����������ɵ�����Ϊ_____________��д��ѧʽ����
���𰸡�2O2--4e-=O2 AB Zn-2e-+2OH- =Zn(OH)2 2Cl2��g��+TiO2��s��+2C��s��=TiCl4��l��+2CO��g����H=��85.6kJmol��1 ��ֱ���糡������![]() ͨ�������ӽ���Ĥ���������ƶ����Ӷ����뽬Һ�� 2
ͨ�������ӽ���Ĥ���������ƶ����Ӷ����뽬Һ�� 2![]() +2H+
+2H+![]()
![]() +H2O�� NaOH��H2
+H2O�� NaOH��H2
��������
��1���������ﺬ��Al��OH��3��MnO2������NaOH��Һ�����ˣ��ɵõ���ҺAΪNaAlO2��ͨ�������̼������BΪAl��OH��3������CΪAl2O3��������ڵ��������ɵõ�Al������DΪMnO2��������������Ũ���ᷴӦ������������
��2�������漰�������¶Ⱥ�Ũ�ȣ�
��3������DΪMnO2���Ǽ���п�̵�ص��������õ�صĸ�����пʧ���ӷ���������Ӧ����Ӧ����ʽZn-2e-+2OH- =Zn(OH)2 ��
��4��0.2molCl2�뽹̿��TiO2��ȫ��Ӧ������CO��TiCl4���۵�-25��,�е�136��4�棩����8.56kJ����2mol������Ӧ�ų�������Ϊ2��0.2��8.56kJ=85.6kJ���������غ��֪��ԭ������ΪCO����Ӧ�Ļ�ѧ����ʽΪ2Cl2��g��+TiO2��s��+2C��s���TTiCl4��l��+2CO��g�����Դ˿ɼ��㷴Ӧ�Ȳ�д���Ȼ�ѧ����ʽ��
��5�����ʱ��CrO42��ͨ�������ӽ���Ĥ�������ƶ�������������ԭ��Ӧ����������NaOH���ɴ˽��
��1��C��Al���Ʊ�������Ϊ��ⷨ������CΪAl2O3��������ڵ��������ɵõ�Al��������Ӧ����ʽ2O2--4e-=O2��
��2����Ӧ�漰������Ϊ���ȣ������¿ɷ�Ӧ������������ᣬ������Ũ�ȱ仯����֪Ӱ�������Ϊ�¶Ⱥ�������Ũ�ȣ���ѡ��AB��
��3������DΪMnO2���Ǽ���п�̵�ص��������õ�صĸ�����пʧ���ӷ���������Ӧ����Ӧ����ʽZn-2e-+2OH- =Zn(OH)2 ��
��4��0.2molCl2�뽹̿��TiO2��ȫ��Ӧ������CO��TiCl4���۵�-25��,�е�136��4�棩����8.56kJ����2mol������Ӧ�ų�������Ϊ2��0.2��8.56kJ=85.6kJ�������Ȼ�ѧ����ʽΪ2Cl2��g��+TiO2��s��+2C��s���TTiCl4��l��+2CO��g����H=-85.6kJ��mol��1��
��5�����ʱ��CrO42��ͨ�������ӽ���Ĥ�������ƶ����Ӷ��ӽ�Һ�з�������������2CrO42��+2H��![]() Cr2O72��+H2O��������Ԫ�ص�������CrO42����Cr2O72��������������ԭ��Ӧ����������NaOH��
Cr2O72��+H2O��������Ԫ�ص�������CrO42����Cr2O72��������������ԭ��Ӧ����������NaOH��

����Ŀ���л���A���������Ƿ��͵õ���Ҳ���Դ�ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
(1)��ȡA9.0g������ʹ�������������ܶ�����ͬ������H2��45 ���� | (1)A����Է�������Ϊ��_____________�� |
(2)��9.0gA��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g�� | (2)A�ķ���ʽΪ��______________�� |
(3)��ȡA9.0g����������NaHCO3��ĩ��Ӧ������2.24LCO2(��״��)���������������Ʒ�Ӧ������2.24 L H2(��״��)�� | (3)�ýṹ��ʽ��ʾA �к��еĹ�����__________�� |
(4)A�ĺ���������������ͼ��
| (4)A�к���������ԭ�ӡ� |
(5)����������A �Ľṹ��ʽΪ__________, д��������A����ȥ������ˮ�γ�һ����Ԫ��״������Ļ�ѧ����ʽ_______________________________________ (6)A�ж���ͬ���칹�壬����һ���ܷ���������Ӧ��1mol����ͬ���칹���������Ľ����Ʒ�Ӧ����1molH2�������ͬ���칹��Ľṹ��ʽΪ ____________�� | |