题目内容
【题目】目前比较热门的Al-H2O2电池,其电池总反应为2Al+![]() =
=![]() +OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
+OH-+H2O。现以AlH2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法正确的是
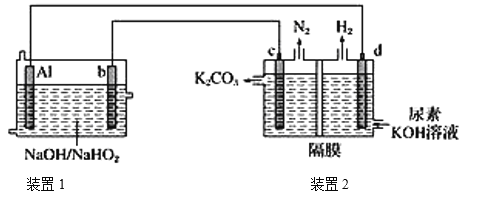
A.装置1中Na+移向电极b,装置2中的隔膜可以换成质子交换膜
B.电极c的电极反应式:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O
C.电解时,电流的流动路径:Al极→导线→d极→电解质溶液→c极→导线→b极
D.通电5 min后,若Al电极的质量减轻5.4g,则产生H2的体积为4.48L(标准状况)
【答案】B
【解析】
H2O2-Al燃料电池工作时,Al失去电子、被氧化、为负极,H2O2得到电子、被还原、为正极,原电池内电路中阳离子移向正极、阴离子移向负极。电解池中,c与原电池的正极相接,为阳极,d与原电池的负极相接,为阴极,电解尿素[CO(NH2)2]的碱性溶液时,阳极[CO(NH2)2]中氮元素化合价由-3价变为0价、发生氧化反应生成氮气,阴极的氢离子化合价由+1价变为0价、发生还原反应生成氢气,电流方向为b→c→d→a,因电子不在水溶液中传导,电子流向:Al极→导线→d极,c极→导线→b极。
A.装置1是原电池,原电池内电路中阳离子移向正极、阴离子移向负极,即Na+移向正极电极b;电解尿素[CO(NH2)2]的碱性溶液时,装置2中的隔膜不可以换成质子交换膜,故A错误;
B.电极c为阳极,碱性条件下,[CO(NH2)2]在阳极失去电子生成氮气和CO32-,所以电极反应式为CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O,故B正确;
C.电子从原电池负极→电解池阴极,从电解池阳极→原电池正极,因电子不在水溶液中传导,即Al极→导线→d极,c极→导线→b极,故C错误;
D. 每消耗2.7g Al,则转移0.3mol电子,电解池中阴极氢离子由+1价变为0价,可生成0.15mol氢气。通电5 min后,若Al电极的质量减轻5.4g,理论上产生气体体积为0.15mol×2×22.4L·mol-1=6.72L(标准状况下),故D错误;
故选B。

 阅读快车系列答案
阅读快车系列答案