题目内容
8.若NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压下,11.2L氧气含有的原子数目为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 在标准状况下,22.4 L水的质量约为18g | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA |
分析 A、依据气体摩尔体积应用条件分析,标准状况气体摩尔体积为22.4L/mol;
B、根据碳酸钠的质量计算出 物质的量,再计算出含有钠离子的物质的量及数目.
C、水在标准状况不是气体;
D、溶液体积不知不能计算微粒数.
解答 解:A、依据气体摩尔体积应用条件分析,标准状况气体摩尔体积为22.4L/mol,常温常压下,11.2L氧气物质的量小于0.5mol,故A错误;
B、1.06g碳酸钠的物质的量为0.01mol,含有钠离子的物质的量为0.02mol,含有的Na+离子数为0.02NA,故B正确;
C、水在标准状况不是气体,在标准状况下,22.4 L水物质的量不是1mol,故C错误;
D、溶液体积不知,物质的量浓度为0.5mol/L的MgCl2溶液中不能计算氯离子微粒数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件分析,物质的量计算微粒数,题目较简单.

练习册系列答案
 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
18.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 碳酸钙高温下分解 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
19.某元素X的最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中,X元素的化合价为( )
| A. | 3n-12 | B. | 5n-12 | C. | 3n-6 | D. | n-10 |
16.关于物质的用途下列说法正确的是( )
| A. | 氢氧化铝可以用做耐火材料 | |
| B. | 铝热反应能放出大量的热,常用于焊接钢轨等 | |
| C. | 铝合金具有密度大、强度高且有一定的抗腐蚀能力,可用于制造能承受强磨损的构件 | |
| D. | 铜被誉为“21世纪的金属”,其应用前景更为广阔 |
3.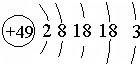 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
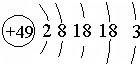 张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )
张青莲是我国著名的化学家.1991年,他准确测得In的相对原子质量为114.818,被国际原子量委员会采用为新的标准值.这是原子量表中首次采用我国测定的相对原子质量值.已知In的原子结构如图所示,则下列关于In的说法不正确的是( )| A. | In为长周期元素 | B. | In的最高正化合价为+3 | ||
| C. | In容易导电导热 | D. | In和铝同主族,金属性比铝弱 |
13.室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7.下列说法正确的是( )
| A. | 未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-)>c(OH-)>c(H+) | |
| B. | 加稀盐酸后溶液中c(CN-)+c(HCN)=c(Na+) | |
| C. | pH=7时,溶液中:c( Na+)=c( CN-) | |
| D. | 加稀盐酸后H2O的电离程度减小 |
20.下列物质加入到氢氧化钠溶液中,有气体生成的是( )
| A. | 金属钠 | B. | 过氧化钠 | C. | 金属镁 | D. | 金属铝 |
17.利用如图所示的有机物X可生产S-诱抗素Y.下列说法正确的是( )
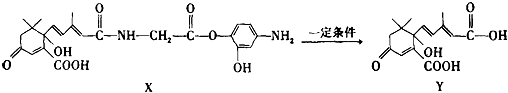

| A. | X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐 | |
| B. | Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 | |
| C. | 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH | |
| D. | X结构中有2个手性碳原子 |
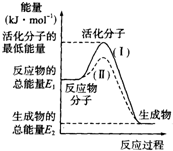 (1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.