题目内容
13.室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7.下列说法正确的是( )| A. | 未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-)>c(OH-)>c(H+) | |
| B. | 加稀盐酸后溶液中c(CN-)+c(HCN)=c(Na+) | |
| C. | pH=7时,溶液中:c( Na+)=c( CN-) | |
| D. | 加稀盐酸后H2O的电离程度减小 |
分析 A.等物质的量的NaCN和HCN混合,HCN电离小于CN-水解,溶液呈碱性;
B.根据物料守恒分析判断;
C.pH=7时,c(OH-)=c(H+),结合电荷守恒判断;
D.加稀盐酸抑制HCN的电离,但酸性增强;氢离子抑制了水的电离.
解答 解:A.等物质的量的NaCN和HCN混合,HCN电离小于CN-水解,溶液呈碱性,则c( CN-)<c(HCN),溶液中离子浓度大小为:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+),故A正确;
B.加稀盐酸后溶液中,根据物料守恒可得:c(HCN)+c(CN-)=2c(Na+),故B错误;
C.pH=7时,c(OH-)=c(H+),由电荷守恒可知:c( Na+)+c(H+)=c(CN-)+c(OH-)+c(Cl-),则c( Na+)=c(CN-)+c(Cl-),故C错误;
D.加稀盐酸,抑制HCN的电离,但酸性增强,溶液中c(H+)增大,氢离子抑制了水的电离,则H2O的电离程度减小,故D正确;
故选AD.
点评 本题考查离子浓度的大小比较等问题,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.质谱图显示,某化合物的相对分子质量为74,燃烧实验发现其分子内碳、氢原子个数之比为2:5,核磁共振氢谱显示,该物质中只有两种类型的氢原子.关于该化合物的描述中,不正确的是( )
| A. | 该化合物可能为2甲基2丙醇 | B. | 该化合物为2丁醇的同分异构体 | ||
| C. | 该化合物可能为乙醚 | D. | 该化合物为乙醚的同系物 |
4.下列化合物中,含有非极性共价键的离子化合物是( )
| A. | Na2O2 | B. | H2SO4 | C. | Ba(OH)2 | D. | N2 |
1.浓硫酸有吸水性,常用作气体干燥剂,下列气体不能用浓硫酸干燥的是( )
| A. | Cl2 | B. | NH3 | C. | SO2 | D. | CH4 |
8.若NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,11.2L氧气含有的原子数目为NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| C. | 在标准状况下,22.4 L水的质量约为18g | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA |
5.下列离子方程式正确的是( )
| A. | 向漂白粉溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 将Na2O2固体投入H218O中:2Na2O2+2H218O═4Na++4OH-+18O2↑ | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |

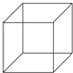 立方烷的结构简式如图所示,每个顶点是一个碳原子.则:
立方烷的结构简式如图所示,每个顶点是一个碳原子.则: