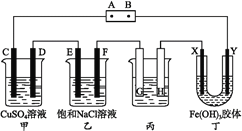
题目内容
【题目】苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
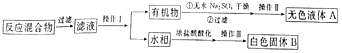
已知:苯甲酸相对分子质量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点。
(1)操作1为_________________,操作Ⅱ为“蒸馏”,需选用的玻璃仪器除了圆底烧瓶、蒸馏头、温度计、接收管(牛角管)之外,还有___________(填序号)
A.球形冷凝管 B.直形冷凝管 C.接收瓶 D.烧杯
(2)操作Ⅲ具体实验步骤依次为__________、抽滤。将物质放在布氏漏斗中打开抽气泵一段时间后布氏漏斗中剩余的是白色固体B,抽滤装置可以加快过滤速率其工作原理是_______
(3)测定白色固体B的熔点,发现其在115℃开始熔化达到130℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与少量KCl的混合物。
①欲从混合物中提纯苯甲酸应进行的操作是_______________________
②在①提纯过程中应对晶体进行洗涤除去晶体表面附着杂质,如何检验洗涤已经完全:_______
③欲检验经过①提纯后的固体是否纯净,可以采用的实验方法是______,如果固体纯净对应的现象是___________________________
(4)纯度测定:称取1.220g产品,配成100mL甲醇溶液移取25.00mL溶液滴定,消耗KOH的物质的量为2.40×10-3mol产品中苯甲酸质量分数为_________(保留两位有效数字)。
【答案】分液 BC 蒸发浓缩、冷却结晶 抽出装置中的空气,形成压强差,使过滤加快 重结晶 取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,没有白色沉淀生成,说明洗涤完全 测定固体熔点 白色晶体在122.4℃左右完全熔化 96%
【解析】
(1)根据分离不互溶的液体混合物采用分液的方法分析,根据蒸馏实验中需要进行加热和冷却和接收分析使用的仪器。
(2)根据苯甲酸的溶解度随温度的变化分析分离的操作。
(3)根据固体可能吸附氯离子,氯离子能与硝酸银反应生成白色氯化银沉淀进行分析。
(4)根据纯净物有固定的熔点分析检验方法。
(5)根据苯甲酸为一元酸,与氢氧化钾反应比例为1:1进行计算苯甲酸的质量分数。
(1)操作Ⅰ为分离有机物和水,属于分离分层的液体混合物,为分液操作,操作Ⅱ为“蒸馏”,需圆底烧瓶、蒸馏头、温度计、接收管(牛角管)和直形冷凝管和接收瓶,故选BC;
(2)苯甲酸相对分子质量是122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g,因为分离苯甲酸用重结晶的方法,操作为蒸发浓缩、冷却结晶;抽滤过程中抽出装置中的空气,形成压强差,使过滤加快;
(3)①因为苯甲酸在不同温度下的溶解度差异较大,所以用重结晶的方法分离;
②固体表面可能吸附氯离子,所以取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,没有白色沉淀生成,说明没有氯离子,洗涤完全;
③纯净固体有机物一般都有固定熔点,所以可以测定固体熔点;若白色晶体在122.4℃左右完全熔化,说明固体为纯的苯甲酸。
(4)苯甲酸是一元弱酸和氢氧化钾按1:1反应,所以苯甲酸的质量分数为![]() =96%。
=96%。

 阅读快车系列答案
阅读快车系列答案【题目】将1 mol N2和 3 mol H2充入体积可变的恒温密闭容器中,在380 ℃下发生反应:N2(g)+3H2(g)![]() 2NH3(g),平衡时,体系中氨的体积分数
2NH3(g),平衡时,体系中氨的体积分数![]() (NH3)随压强变化的情况如下表:
(NH3)随压强变化的情况如下表:
压强/MPa | 10 | 20 | 30 | 40 |
| 0.30 | 0.45 | 0.54 | 0.60 |
下列说法正确的是( )
A.10 MPa时,H2的转化率为75%
B.20 MPa时,NH3的物质的量浓度是10 MPa时的1.5倍
C.40 MPa时,若容器的体积为V L,则平衡常数K=![]()
D.30 MPa时,若向容器中充入惰性气体,则平衡向正反应方向移动