题目内容
20.同温同浓度的条件下,NaHCO3和NaHSO4溶液中水的电离程度前者与后者之间的关系是( )| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
分析 酸溶液和碱溶液抑制了水的电离,酸溶液中的氢离子、碱溶液中的氢氧根离子浓度越大,水的电离程度越小;能够水解的盐溶液促进了水的电离,水解程度越大,水的电离程度越大,据此进行解答.
解答 解:NaHSO4为酸性溶液,溶液中氢离子浓度为硫酸氢钠的浓度,相当于一元强酸,抑制水的电离,NaHCO3为强碱弱酸盐,碳酸氢根离子的水解,促进了水的电离,故选A.
点评 本题考查了水的电离、盐的水解原理离及其影响因素,题目难度不大,注意掌握盐的水解原理、水的电离及其影响因素,明确酸溶液和碱溶液抑制了水的电离,能够水解的盐溶液促进了水的电离.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.燃烧等物质的量有机物A和乙醇,消耗等量的氧气.此时乙醇反应后生成的H2O是A的1.5倍,而有机物A反应后生成的CO2是乙醇的1.5倍.则有机物A的分子式为( )
| A. | C2H4O | B. | C2H6O | C. | C3H4O2 | D. | C3H6O2 |
11.下列物质的保存方法不正确的是( )
| A. | 氯水存放在带橡胶塞的棕色广口瓶中 | |
| B. | 少量钠保存在煤油中 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 碳酸钠固体保存在广口瓶中 |
8.下列措施对增大反应速率明显有效的是( )
| A. | 在炭粉燃烧中加入KClO3 | |
| B. | Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸 | |
| C. | 在K2S04与BaCl2两溶液反应时,增大压强 | |
| D. | Na与乙醇反应时增大乙醇的用量 |
15.下列有关化学用语表示正确的是( )
| A. | 比例模型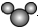 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 | |
| B. | 电子式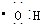 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| C. | 离子结构示意图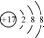 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| D. | 离子方程式HCO3-+H2O?H3O++CO32-可以表示HCO3-离子的水解,也可以表示它的电离 |
12.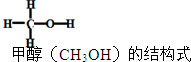 已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表
已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表
则CO中碳氧键的键能为( )
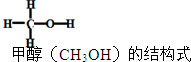 已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表
已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ/mol) | 436 | 414 | 326 | 464 |
| A. | 1070 kJ/mol | B. | 1080 kJ/mol | C. | 1090 kJ/mol | D. | 1100 kJ/mol |
9.下列说法中,正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 燃煤发电是煤的综合利用的重要途径 | |
| C. | 反应物的总能量大于生成物的总能量的化学反应是放热反应 | |
| D. | 化学键的断裂和形成与化学变化中的能量变化无关 |
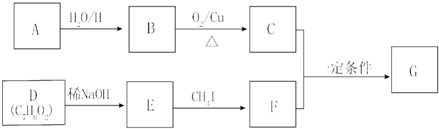
 +RCH2I→
+RCH2I→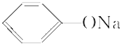
 .
.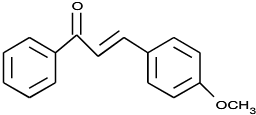 (不要求立体异构).
(不要求立体异构).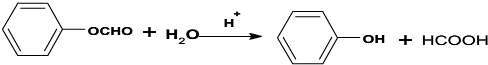 .
.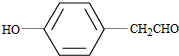 .(写结构简式)
.(写结构简式)