题目内容
12.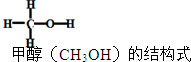 已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表
已知:2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,其他相关数据如表| 共价键 | H-H | C-H | C-O | O-H |
| 键能(kJ/mol) | 436 | 414 | 326 | 464 |
| A. | 1070 kJ/mol | B. | 1080 kJ/mol | C. | 1090 kJ/mol | D. | 1100 kJ/mol |
分析 根据2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,依据△H=反应物的总键能-生成物的总键能计算.
解答 解:由2H2(g)+CO(g)═CH3OH(g)△H=-90kJ/mol,设CO中碳氧键的键能为a,则△H=(436×2+a)kJ/mol-(414×3+326+464)kJ/mol=-90kJ/mol,求得:a=1070kJ/mol,
故选:A.
点评 考查反应热的有关计算、键能与反应热的关系等,难度中等,明确△H=反应物的总键能-生成物的总键能是解题的关键.

练习册系列答案
相关题目
3.将2molA和1mol B充入某密闭容器中发生反应:2A(g)+B(g)?xC(g),达到化学平衡后,C的体积分数为a.假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是( )
| A. | 若在恒温恒压下,当x=1时按1.5 mol A、1molC作为起始物质,平衡后C的体积分数仍为a | |
| B. | 若在恒温恒容下,当x=2时将2molC作起始物质,平衡后C的体积分数仍为a | |
| C. | 若在恒温恒压下,当x=3时1mol A、1mol B、6molC作起始物质,平衡后C的体积分数仍为a | |
| D. | 若在恒温恒容下,按0.6mol A、0.3mol B、1.4molC作起始物质,平衡后C的体积分数仍为a,则x只能等于2 |
20.同温同浓度的条件下,NaHCO3和NaHSO4溶液中水的电离程度前者与后者之间的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
17.将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中充分反应后,放出氢气最多的是( )
| A. | 3mol/LHCl | B. | 4mol/LHNO3 | C. | 8mol/LNaOH | D. | 18mol/LH2SO4 |
4.燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x 极:O2(g)+2H2O(l)+4e-═4OH- y极:2H2(g)+4OH--4e-═4H2O(l) 判断下列说法中正确的是( )
| A. | x极为电池的负极 | B. | x极附近溶液的pH值减小 | ||
| C. | y极发生氧化反应 | D. | 电流由y极流向x极 |
1.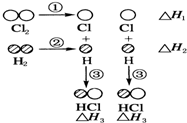 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
H2和Cl2反应生成HCl过程中的热效应可用如图表示,请回答下列问题:
(1)△H1=+243kJ•mol-1,△H2=+436kJ•mol-1,△H3=-431kJ•mol-1.
(2)该反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/kJ•mol-1 | 436 | 243 | 431 |
(1)△H1=+243kJ•mol-1,△H2=+436kJ•mol-1,△H3=-431kJ•mol-1.
(2)该反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
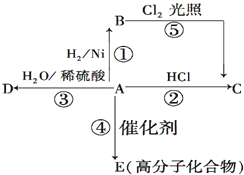 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. (反应类型加聚反应 ).
(反应类型加聚反应 ).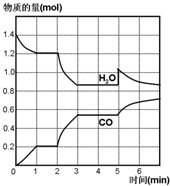 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示: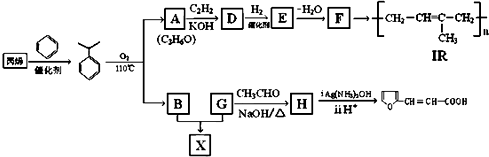
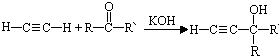
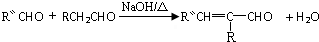
 ,反应类型是加成反应.
,反应类型是加成反应. .
. .
. .
.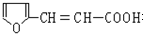 有多种同分异构体,符合下列要求的有6种.
有多种同分异构体,符合下列要求的有6种.