题目内容
13.燃烧等物质的量有机物A和乙醇,消耗等量的氧气.此时乙醇反应后生成的H2O是A的1.5倍,而有机物A反应后生成的CO2是乙醇的1.5倍.则有机物A的分子式为( )| A. | C2H4O | B. | C2H6O | C. | C3H4O2 | D. | C3H6O2 |
分析 由乙醇C2H6O分子中C、H的个数,可确定A的分子式为C3H4Ox,再由消耗O2相等,即2+$\frac{6}{4}$-$\frac{1}{2}$=3+$\frac{4}{4}$-$\frac{X}{2}$,可确定A中氧原子数,以此可确定A的分子式.
解答 解:由乙醇C2H6O分子中C、H的个数,可确定A的分子式为C3H4Ox,再由消耗O2相等,即2+$\frac{6}{4}$-$\frac{1}{2}$=3+$\frac{4}{4}$-$\frac{X}{2}$,可确定A中氧原子为2,所以有机物A的分子式为C3H4O2,
故选:C.
点评 本题考查有机物分子式的确定,难度不大,解答本题时注意从反应的化学方程式的角度分析,注意CO2和H2O的物质的量的关系.

练习册系列答案
相关题目
1.用铝热法从下列金属氧化物中制取相应的金属各1mol,消耗铝的质量最多的是( )
| A. | Fe2O3 | B. | V2O5 | C. | MnO2 | D. | Cr2O3 |
8. 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子最外层有4种不同运动状态的电子,F位于ds区.
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
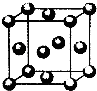
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
18.同体积的1mol/L的HCl、H2SO4、CH3COOH分别加入过量的Mg.下列叙述中正确的是( )
| A. | HCl、H2SO4中放出H2的速率相同 | |
| B. | CH3COOH中放出H2的速率最快 | |
| C. | H2SO4中放出H2的速率最快,CH3COOH中放出H2的速率最慢 | |
| D. | H2SO4中放出H2的量最多,其余的相等 |
20.同温同浓度的条件下,NaHCO3和NaHSO4溶液中水的电离程度前者与后者之间的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
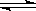 C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
C(g)△H<0。开始充入2mol A和2mol B,并达到平衡状态,下列说法正确的是
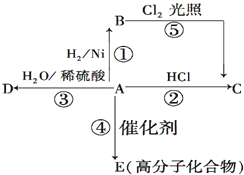 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. (反应类型加聚反应 ).
(反应类型加聚反应 ).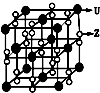 X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题: