题目内容
15.下列有关化学用语表示正确的是( )| A. | 比例模型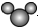 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 | |
| B. | 电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| C. | 离子结构示意图 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| D. | 离子方程式HCO3-+H2O?H3O++CO32-可以表示HCO3-离子的水解,也可以表示它的电离 |
分析 A.二氧化硫分子为V型结构,硫原子半径大于氧原子,二氧化碳为直线型结构;
B.羟基为中性原子团,而氢氧根离子为带有1个单位负电荷的阴离子;
C.36Cl-、37Cl-的离子结构示意图相同,都可以用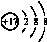 表示;
表示;
D.离子方程式HCO3-+H2O?H3O++CO32-只表示碳酸氢根的电离.
解答 解:A. 为V型结构,只能不是二氧化硫,不能表示二氧化碳,二氧化碳的比例模型为:
为V型结构,只能不是二氧化硫,不能表示二氧化碳,二氧化碳的比例模型为: ,故A错误;
,故A错误;
B.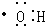 为中性原子团,表示的是羟基,氢氧根离子为阴离子,其电子式为:
为中性原子团,表示的是羟基,氢氧根离子为阴离子,其电子式为: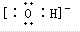 ,故B错误;
,故B错误;
C.36Cl-、37Cl-离子的核电荷数为17,核外电子总数为18,都可以用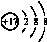 表示,故C正确;
表示,故C正确;
D.离子方程式HCO3-+H2O?H3O++CO32-只表示碳酸氢根的电离,不能表示其水解,其水解应生成碳酸,故D错误,故选C.
点评 本题考查了比例模型、电子式、原子结构示意图、有机物的命名等知识,题目难度中等,注意掌握常见化学用语的概念及表示方法,明确常见有机物的命名原则,选项B为易错点,注意羟基与氢氧根离子的区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8. 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子最外层有4种不同运动状态的电子,F位于ds区.
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
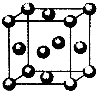
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
6.下列说法不正确的是( )
| A. | 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小 | |
| B. | SO2、CH2═CH2都能使溴水褪色,但原理不同 | |
| C. | NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应 | |
| D. | FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质 |
3.将2molA和1mol B充入某密闭容器中发生反应:2A(g)+B(g)?xC(g),达到化学平衡后,C的体积分数为a.假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是( )
| A. | 若在恒温恒压下,当x=1时按1.5 mol A、1molC作为起始物质,平衡后C的体积分数仍为a | |
| B. | 若在恒温恒容下,当x=2时将2molC作起始物质,平衡后C的体积分数仍为a | |
| C. | 若在恒温恒压下,当x=3时1mol A、1mol B、6molC作起始物质,平衡后C的体积分数仍为a | |
| D. | 若在恒温恒容下,按0.6mol A、0.3mol B、1.4molC作起始物质,平衡后C的体积分数仍为a,则x只能等于2 |
10.某原电池总反应的离子方程式为2Fe3++Fe═3 Fe2+,能实现该反应的原电池组成是( )
| A. | 正极为铁,负极为铜,电解质溶液为FeCl3溶液 | |
| B. | 正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液 | |
| C. | 正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为银,负极为铁,电解质溶液为CuSO4溶液 |
20.同温同浓度的条件下,NaHCO3和NaHSO4溶液中水的电离程度前者与后者之间的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
4.燃料电池是目前正在探索的一种新型电池,现在已经使用的氢氧燃料电池的基本反应是:x 极:O2(g)+2H2O(l)+4e-═4OH- y极:2H2(g)+4OH--4e-═4H2O(l) 判断下列说法中正确的是( )
| A. | x极为电池的负极 | B. | x极附近溶液的pH值减小 | ||
| C. | y极发生氧化反应 | D. | 电流由y极流向x极 |
2.下列关于常见有机物的说法不正确的是( )
| A. | 乙酸和油脂都能与NaOH溶液反应 | |
| B. | 蛋白质、纤维素、蔗糖、油脂都是高分子化合物 | |
| C. | 淀粉水解与纤维素水解得到的最终产物相同 | |
| D. | 乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示: