题目内容
11.下列物质的保存方法不正确的是( )| A. | 氯水存放在带橡胶塞的棕色广口瓶中 | |
| B. | 少量钠保存在煤油中 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 碳酸钠固体保存在广口瓶中 |
分析 A.氯水中的次氯酸有强氧化性;
B.金属钠能与空气中的氧气和水反应,须隔离空气保存;
C.见光易分解的药品应该用棕色试剂瓶存放;
D.液体放在细口瓶中,固体放在广口瓶中.
解答 解:A.氯水中的次氯酸有强氧化性,能氧化橡胶塞,故A错误;
B.金属钠能与空气中的氧气和水反应,须隔离空气保存,钠和煤油不反应且大于煤油密度,所以少量的金属钠可以保存在煤油中,故B正确;
C.浓硝酸见光易分解,通常保存在棕色试剂瓶中,故C正确;
D.碳酸钠固体保存在广口瓶中,故D正确.
故选A.
点评 本题考查化学试剂的存放,题目难度不大,注意把握化学试剂的性质,选择正确的保存方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列说法不正确的是( )
| A. | 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小 | |
| B. | SO2、CH2═CH2都能使溴水褪色,但原理不同 | |
| C. | NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应 | |
| D. | FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质 |
16.下列有机物分子中,所有的原子不可能处于同一平面的是( )
| A. | CH2=CH-CI | B. | CH2=CH-CH=CH2 | C. | CH3-CH=CH2 | D. | 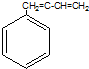 |
3.将2molA和1mol B充入某密闭容器中发生反应:2A(g)+B(g)?xC(g),达到化学平衡后,C的体积分数为a.假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是( )
| A. | 若在恒温恒压下,当x=1时按1.5 mol A、1molC作为起始物质,平衡后C的体积分数仍为a | |
| B. | 若在恒温恒容下,当x=2时将2molC作起始物质,平衡后C的体积分数仍为a | |
| C. | 若在恒温恒压下,当x=3时1mol A、1mol B、6molC作起始物质,平衡后C的体积分数仍为a | |
| D. | 若在恒温恒容下,按0.6mol A、0.3mol B、1.4molC作起始物质,平衡后C的体积分数仍为a,则x只能等于2 |
20.同温同浓度的条件下,NaHCO3和NaHSO4溶液中水的电离程度前者与后者之间的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
1.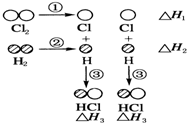 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
H2和Cl2反应生成HCl过程中的热效应可用如图表示,请回答下列问题:
(1)△H1=+243kJ•mol-1,△H2=+436kJ•mol-1,△H3=-431kJ•mol-1.
(2)该反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
 下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):
下表中的数据表示破坏1mol物质中的化学键需消耗的能量(即键能):| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能/kJ•mol-1 | 436 | 243 | 431 |
(1)△H1=+243kJ•mol-1,△H2=+436kJ•mol-1,△H3=-431kJ•mol-1.
(2)该反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ•mol-1.
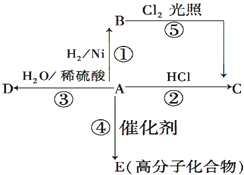 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. (反应类型加聚反应 ).
(反应类型加聚反应 ). X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于同一周期,其中基态Y原子的2p轨道处于半充满状态,Y和Z的单质可以通过分离液态空气的方法大量制得,且XZ2与Y2Z互为等电子体.含U的化合物的焰色为紫色.试回答下列问题: