题目内容
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。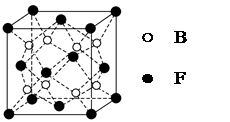
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。
(1)2s22p4(2分) 1s22s22p63s23p6(2分)
(2)Na3AlF6 (2分)
(3)Al2O3为离子晶体(或者;离子化合物)而AlCl3为分子晶体(或共价化合物)(3分)
(4)CaO晶体中Ca2+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷。(2分)
(5)CaF2(1分)  (3分)
(3分)
解析试题分析:由题干知道A、B是第二周期元素,C、D、E是第三周期元素,F是第四周期元素,同时A原子L层上有2对成对电子,则A为O,则B为F,B、C、D的核外电子排布相同的简单离子,说明C、D的阳离子也是两层,再根据CE、FA为电子数相同的离子晶体,D2A3制取D,则C为Na、D为Al、E为Cl、F为Ca。
(1)O元素的基态原子价电子排布式是2s22p4;Ca2+的含18电子,电子排布式是1s22s22p63s23p6。
(2)B为F、C为Na、D为Al可知X为Na3AlF6。
(3)工业制取铝一般不用三氯化铝而用三氧化二铝主要是Al2O3为离子晶体(或者;离子化合物)而AlCl3为分子晶体(或共价化合物);
(4)CaO晶体大于NaCl晶体的晶格能的主要原因是CaO晶体中Ca2+、O2-的带电荷大于NaCl晶体中Na+、Cl-的带电荷;次要原因是离子半径。
(5)根据Ca2+、F-的所带电荷数可以看出以1:2结合,化学式为CaF2;根据晶胞计算出含有4个Ca2+、8个F-,则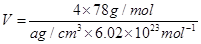 。
。
考点:本题考查元素周期表结构、元素推断、物质结构、晶体的结构与性质、晶胞的计算。

a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c与f反应可形成两个g分子。试写出:
(1)a粒子的核外电子排布式______________________________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱为:________>________ (用化学式表示)。
(3)d溶于水的电离方程式__________________________________________。
(4)c粒子是__________,f粒子是__________(用化学式表示)。
(5)g粒子的共价键数是_____而不是更多,说明共价键具有 性。
X、Y、Z、T、W五种元素的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是______;W元素基态原子电子排布式
为______________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________________。
A.常温下Z的单质和T的单质状态不同
B. T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D. T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的σ键与π键个数比为______,它所形成的晶体类型为______; Y的常见氢化物易液化的主要原因是________________________。
(4)元素X与钙元素可以形成一种离子化合物,该化合物的阴离子和CO互为等电子体,该化合物的电子式为 ;其中元素X的杂化类型是 。
X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X有多种同素异形体,写出X2电子式是 ,
(2)X、Y、Z三种元素电负性由大到小顺序为_____。
(3)W元素原子基态时原子的电子排布式_________________。
(4)Z位于元素周期表第 周期第 族
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH (填“=”、“>”或“<”),理由是: (用离子方程式表示)。
(6).25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。
A、B、C、D、E、F是元素周期表前四周期的六种元素,原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| A | 原子的核外电子数和电子层数相等 |
| B | 基态原子价电子排布为nsnnpn |
| C | 气态氢化物与最高价氧化物的水化物反应生成盐 |
| D | 基态原子电子排布有2个未成对电子 |
| E | 位于第三周期,在同周期中原子半径最大 |
| F | 与B 形成的合金为目前用量最多的金属材料 |
(1)C位于元素周期表第 周期第 族。F元素基态原子的核外电子排布式是 。
(2)六种元素中,电负性最大的元素是 (填元素符号),D的一种核素原子核内有10个中子,该核素的符号是 。
(3)E2D2的电子式是 ,BD2的晶体类型为 。化合物丙由D、F两种元素组成,丙可作油漆的一种颜料,化合物丁由B、D两种元素组成。工业上由丙和丁在高温下反应生产F的单质,写出该反应的化学方程式: 。
(4)在2L密闭容器中加入3molA2和一定量C2发生反应:3A2+C2
 2CA3△H<0,反应10min达到平衡,生成0.2molCA3。
2CA3△H<0,反应10min达到平衡,生成0.2molCA3。①该反应平衡常数表达式为(各物质均写化学式)K=
②从起始到平衡,以C2浓度变化表示的平均反应速率为

 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。