题目内容
写出10电子微粒
①原子__ ___② 分子___________________________
③ 阴离子______________________④ 阳离子_________________________
① 原子:Ne ② 分子:HF H2O NH3 CH4
③ 阴离子:F- O2- N3- OH- NH2- ④ 阳离子:Na+ Mg2+ Al3+ H3O+ NH4+
解析试题分析:在10电子微粒中,常见的原子有Ne;分子有HF、H2O、NH3、CH4;阴离子有F-、O2-、N3-、OH-、 NH2-;阳离子有Na+、Mg2+、Al3+、H3O+、NH4+。
考点:考查常见10电子微粒的判断
点评:该题是高考中的常见考点,属于基础性试题的考查,有利于培养学生的逻辑思维能力和发散思维能力。本题主要考查学生对化学用语的书写和理解能力,答题时注意利用质子数和电子数的关系及正确理解阴阳离子的电荷数来计算,考查全面,注重基础,试题难易适中。

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
下列是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素是 (填元素符号),画出该元素的原子结构示意图: 。
(2)W、X和Y可组成一化合物,其原子个数比为4:3:2,则该化合物属 (填“离子化合物”或“共价化合物”),存在的化学键是 。写出该化合物与由W、R和X按原子个数比为1:1:1组成化合物反应的化学方程式:
。
(3)写出下列反应的化学方程式:
Z的单质与Y元素的最高价氧化物对应的水化物反应: 。
(13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
| R | 有多种化合价,其最高正价为+6价 |
(1)写出下列元素的名称:C ,E ;画出B的阴离子结构示意图: 。
(2)B、C、D的简单离子半径由大到小的顺序是 (用化学式表示)。E元素的最高价含氧酸的化学式是 ;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是: 。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是 (填序号)。
A.元素R位于周期表中第3 周期,ⅥA族
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。 ; 。
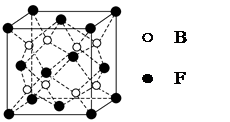
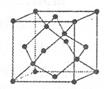

 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。