题目内容
A、B、C、D代表4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,A元素的名称是 ,该元素的原子核外共有 种不同运动状态的电子;该元素的第一电离能比后面一号元素大的原因是 。
(2)B为元素周期表中的29号元素,常与H2O、NH3等形成配合物。
B的无水硫酸盐晶体呈 色,向盛有B的硫酸盐水溶液的试管里逐滴加入氨水,首先形成 ,继续添加氨水,沉淀溶解得到 ,写出后一步反应的离子方程式 。
(3)C元素的负一价离子的电子层结构与氩相同,C的最高价氧化物的水化物的化学式为 。
(4)A元素的最高价氧化物对应的水化物的稀溶液与29号元素的单质反应的离子方程式是____________________。
(5)D元素在元素周期表的各元素中,电负性仅小于氟,A的最低价氢化物与D的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为___________________。
(1)氮;(1分)7;(1分)氮原子的最外层处于2s全充满,2p能级为半充满的 较稳定状态。(1分)
(2)白;(1分)蓝色沉淀;(1分)深蓝色溶液;(1分)
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-(2分)(反应物中NH3写成NH3·H2O也可)
(3)HClO4(1分)
(4)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(5)2NH3+3H2O2=N2+6H2O (2分)
解析试题分析:(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,该元素电子排布只能为1s22s22p3,该元素为N元素。N元素核外共有7电子,故有7种不同运动状态的电子。该元素的第一电离能比后面一号元素大的原因是氮原子的最外层处于2s全充满,2p能级为半充满的 较稳定状态。
(2)29号元素为铜元素,无水硫酸盐晶体为无水硫酸铜,为白色。当想硫酸铜溶液中加入氨水,首先形成氢氧化铜蓝色絮状沉淀,继续加入氨水,沉淀溶解,形成配合物氢氧化二氨合铜,溶于水。离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-。
(3)C元素的负一价离子的电子层结构与氩相同,即该元素为17号元素,氯元素。则其最高价氧化物的水化物为HClO4
(4)A元素为氮元素,最高价氧化物对应的水化物的稀溶液为稀硝酸,29号元素为铜元素,故,其离子反应方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(5)D元素在元素周期表的各元素中,电负性仅小于氟,则D为氧元素。A为氮元素,其最低价氢化物为NH3,D的氢化物有H2O、H2O2两种,能有氨气发生反应的只有H2O2。故,其反应方程式为2NH3+3H2O2=N2+6H2O 。
考点:元素周期律、电负性、离子反应方程式、原子核外电子排布。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案根据下列五种元素的第一至第四电离能数据(单位: kJ·mol-1),回答下列各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 496 | 4 562 | 6 912 | 9 543 |
| S | 738 | 1 451 | 7 733 | 10 540 |
| T | 578 | 1 817 | 2 745 | 11 575 |
| U | 420 | 3 100 | 4 400 | 5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____。
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:______,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第_____个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是__________________。
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体。请回答下列问题(涉及物质均用化学式表示)。
(1)离子化合物ZX中X离子的结构示意图为 ; Y在元素周期表中的位置是_______________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________,Q与G的气态氢化物还原性更强的是__________________。
(3)工业上制备M的高纯度单质,其中一个重要反应是:由MXG3与X2在高温下反应。该反应过程必须控制无水无氧,因为MXG3遇水剧烈反应生成H2、 和 ,而混入氧气,引起的后果是 。
(4)X2Q的燃烧热为a kJ·mol-1,下列X2Q燃烧反应的热化学方程式正确的是 。
| A.2X2Q(g) + O2(g) =" 2Q(s)" + 2X2O(g)△H=" -2a" kJ·mol-1 |
| B.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" +a" kJ·mol-1 |
| C.2X2Q(g)+ 3O2(g) = 2QO2(g) + 2X2O(l)△H=" -2a" kJ·mol-1 |
| D.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" -a" kJ·mol-1 |
 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
请按要求回答下列问题:
(1)画出元素②的原子结构示意图 。
(2)属于稀有气体的元素编号是_______,可作半导体材料的元素编号是______。
(3)③、⑦两种元素相比较,非金属性强的是 (填元素符号)。
(4)元素④的单质与元素⑤的单质反应可生成两种化合物,化学式分别是 , 。
(5)元素③和元素⑧的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可
看到大量的白烟,写出产生该现象的化学方程式: 。
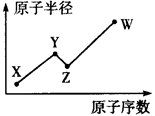
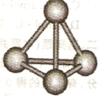
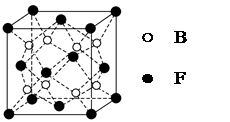

 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。