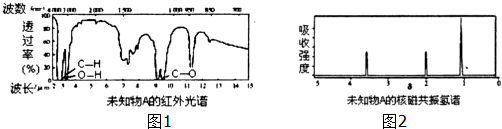
题目内容
5.A、B、C、D、E 5种元素,已知:①A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同.E原子M层上的电子比K层多5个.
②常温下B2是气体,它对氢气的相对密度是16.
③C的单质在B2中燃烧,生成淡黄色固体F.F与AB2反应可生成B2.
④D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2.DB2中D的质量分数为50%.根据以上情况回答:
(1)A是C、B是O、C是Na、D是S、E是Cl(写元素符号).
(2)E的原子结构示意图
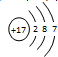 ,C的离子结构示意图
,C的离子结构示意图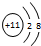 .
.(3)F和AB2反应的化学方程式2CO2+2Na2O2=2Na2CO3+O2.
分析 A、B、C、D、E 5种元素,已知:A原子最外层电子数是次外层电子数的两倍,则A原子只能有2个电子层,最外层电子数为4,故A为碳元素;E原子M层上的电子比K层多5个,则其M层电子数为7,故E为Cl;常温下B2是气体,它对氢气的相对密度是16,则B2的相对分子质量为32,B的阴离子与氖原子的电子层结构相同,所以B为O元素;C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2,则F为Na2O2,DB2中D的质量分数为50%,则D的相对原子质量=32,D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2,则D为S元素,据此答题.
解答 解:A、B、C、D、E 5种元素,已知:A原子最外层电子数是次外层电子数的两倍,则A原子只能有2个电子层,最外层电子数为4,故A为碳元素;E原子M层上的电子比K层多5个,则其M层电子数为7,故E为Cl;常温下B2是气体,它对氢气的相对密度是16,则B2的相对分子质量为32,B的阴离子与氖原子的电子层结构相同,所以B为O元素;C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2,则F为Na2O2,C为Na,DB2中D的质量分数为50%,则D的相对原子质量=32,D的单质在B2中燃烧,发出淡紫色火焰,生成有刺激性气味的气体DB2,则D为S元素,
(1)根据上面的分析可知,A是C,B是O,C是Na,D是S,E是Cl,
故答案为:C;O;Na;S;Cl;
(2)E是Cl,E的原子结构示意图为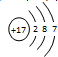 ,C是Na,C的离子结构示意图为
,C是Na,C的离子结构示意图为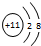 ,
,
故答案为: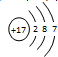 ;
;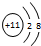 ;
;
(3)Na2O2和CO2反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,
故答案为:2CO2+2Na2O2=2Na2CO3+O2.
点评 本题考查结构性质位置关系,侧重对原子结构示意图、化学方程式等化学用语的考查,难度不大,注意掌握常见化学用语的规范书写.

 阅读快车系列答案
阅读快车系列答案| A. | 二氧化碳 | B. | 乙醇 | C. | 铜 | D. | 硝酸钾 |
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和 2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(3)下列描述中能说明上述反应已达平衡的是BC;
A.2v(H2)正=v(CH3OH)逆 B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变 D.单位时间内生成 n molCO 的同时生成 2n molH2.
| A. | 16 | B. | 14 | C. | 12 | D. | 28 |
| A. | 使用催化剂可加快SO2转化为SO3的速率 | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 装有NO2、N2O4平衡混合气的玻璃球在冷水中气体颜色变浅 | |
| D. | SO2通入氯水,氯水的颜色变浅 |
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| B. | H2C=CH2+Br2→CH3CHBr | |
| C. |  | |
| D. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2CH3+H2O |
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
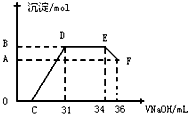
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为NH4++OH-═NH3•H2O.
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.