题目内容
15.下列物质中属于电解质的是( )| A. | 二氧化碳 | B. | 乙醇 | C. | 铜 | D. | 硝酸钾 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质.
解答 解:A.二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,故A错误;
B.乙醇在水溶液里或熔融状态下都不导电,是非电解质,故B错误;
C.铜是单质,所以铜既不是电解质也不是非电解质,故C错误;
D.硝酸钾在水溶液里能电离出自由移动的阴阳离子导致溶液导电,所以硝酸钾是电解质,故D正确.
故选D.
点评 本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,单质和混合物既不是电解质也不是非电解质.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
5.下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 操 作 | 现 象 | 解释或结论 |
| A. | 过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B. | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3氧化,形成致密的氧化膜 |
| C. | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| D. | 向紫色石蕊试液中通入SO2 | 溶液褪色 | SO2有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
6. 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.
(1)A的官能团名称为羟基,对A的描述正确的是C.
①有毒 ②无色无味 ③密度比水小 ④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤B.②③④C.③④⑥D.④⑤⑥
(2)B的电子式为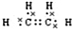 ,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
(3)工业上,D来源于煤干馏(填操作名称)后的液态产物煤焦油.D在浓硫酸、50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为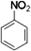 .
.
(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件).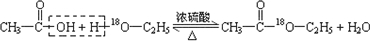 .
.
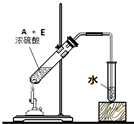
如图为实验室进行该反应时的装置图,其中有4处错误.
 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶. | 其产量用来衡量一个国家的石油化工水平. | 比例模型为: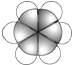 | ①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体. | 由5个原子组成的10个电子的共价分子. |
①有毒 ②无色无味 ③密度比水小 ④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤B.②③④C.③④⑥D.④⑤⑥
(2)B的电子式为
 ,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)(3)工业上,D来源于煤干馏(填操作名称)后的液态产物煤焦油.D在浓硫酸、50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为
 .
.(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件).
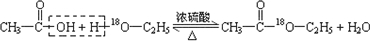 .
.如图为实验室进行该反应时的装置图,其中有4处错误.
20.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| B. | 用Ba(NO3)2溶液鉴别Cl-、SO42-、CO32- | |
| C. | 检验某溶液中是否含有SO42-时,应取少量的该溶液,依次加入BaCl2和稀盐酸 | |
| D. | 验证某溶液中是否含Cl-,先加入过量的稀硝酸,再加入AgNO3溶液,有白色沉淀,则证明含Cl- |
7.工业上铁的冶炼是在炼铁高炉中进行的,发生的反应是 Fe2O3+3CO═2Fe+3CO2,此反应属于( )
| A. | 化合反应 | B. | 氧化还原反应 | C. | 置换反应 | D. | 分解反应 |
4.(1)在25℃、101kPa下,1g乙烷燃烧生成CO2和液态水时放热QkJ.则表示乙烷燃烧热的热化学方程式为C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-30QkJ/mol.
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ•mol-1):
根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)═CF4(g)+4HF(g)△H=-1928kJ/mol.
(3)下列说法不正确的是(填序号)AD
A.某温度下纯水中的C(H+)=10-6,故其显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.相同温度下,0.1mol•L-1NH4Cl溶液中NH4+的浓度比0.1mol•L-1氨水中NH4+的浓度大;
D.相同温度下,PH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大;
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小.
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ•mol-1):
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)═CF4(g)+4HF(g)△H=-1928kJ/mol.
(3)下列说法不正确的是(填序号)AD
A.某温度下纯水中的C(H+)=10-6,故其显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.相同温度下,0.1mol•L-1NH4Cl溶液中NH4+的浓度比0.1mol•L-1氨水中NH4+的浓度大;
D.相同温度下,PH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大;
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小.
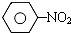 $\stackrel{Fe、HCl、H_{2}O}{→}$
$\stackrel{Fe、HCl、H_{2}O}{→}$
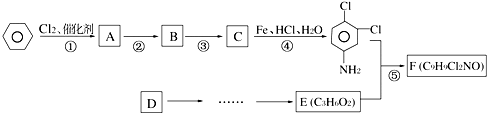
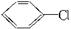 .反应②条件为浓硫酸加热.
.反应②条件为浓硫酸加热.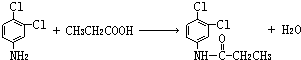 ;该反应的反应类型为取代反应.
;该反应的反应类型为取代反应.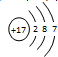 ,C的离子结构示意图
,C的离子结构示意图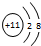 .
.