题目内容
10.下列事实能用勒沙特列原理(化学平衡移动原理)解释的是( )| A. | 使用催化剂可加快SO2转化为SO3的速率 | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 装有NO2、N2O4平衡混合气的玻璃球在冷水中气体颜色变浅 | |
| D. | SO2通入氯水,氯水的颜色变浅 |
分析 勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,与平衡移动无关,则不能用勒沙特列原理解释.
解答 解:A、使用催化剂平衡不移动,所以不能用勒沙特列原理(化学平衡移动原理)解释,故A不选;
B、H2、I2、HI平衡混合气加压,平衡不移动,但碘蒸气浓度变大,导致颜色变深,所以不能用勒沙特列原理(化学平衡移动原理)解释,故B不选;
C、可逆反应2NO2(g)?N2O4(g)(正反应为放热反应),降低温度,平衡正向移动,气体颜色变浅,故C选;
D、SO2通入氯水,是二氧化硫与氯水发生氧化还原反应,导致氯气的浓度减少,所以不能用勒沙特列原理(化学平衡移动原理)解释,故D不选;
故选C.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.

练习册系列答案
相关题目
20.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| B. | 用Ba(NO3)2溶液鉴别Cl-、SO42-、CO32- | |
| C. | 检验某溶液中是否含有SO42-时,应取少量的该溶液,依次加入BaCl2和稀盐酸 | |
| D. | 验证某溶液中是否含Cl-,先加入过量的稀硝酸,再加入AgNO3溶液,有白色沉淀,则证明含Cl- |
1.下列溶液中的氯离子浓度 与50mL 1mol•L-1的AlCl3溶液中氯离子浓度相等的是( )
| A. | 150mL 1mol•L-1的NaCl | B. | 25mL 2mol•L-1的FeCl3 | ||
| C. | 150mL 3mol•L-1的KCl | D. | 75mL 2mol•L-1的CaCl2 |
15.下列物质属于硅酸盐产品的是( )
| A. | 尼龙绳 | B. | 保鲜膜 | C. | 青花瓷 | D. | 金刚石 |
19.已知34Se、35Br位于同一周期,下列关系正确的是( )
| A. | 热稳定性:HCl>H2Se>HBr | B. | 还原性:Se2->S2->Cl- | ||
| C. | 原子半径:Se>Cl>P | D. | 酸性:H2SeO4>H2SO4>H3PO4 |
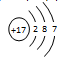 ,C的离子结构示意图
,C的离子结构示意图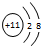 .
.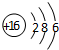 .
.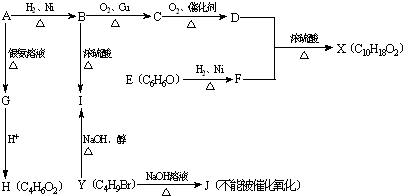
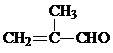 ;J的结构简式为
;J的结构简式为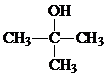 .
.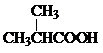 +
+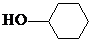 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$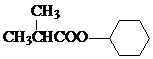 +H2O.
+H2O.