题目内容
13.长征二号火箭巨大的推力来源于一个氧化还原反应,反应时偏二甲肼(C2H8N2)做燃料,N2O4做氧化剂,生成三种气体物质.(l)完成并配平该燃烧反应的化学方程式:
1C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑
(2)火箭发射前低温加注的液态氧化剂N2O4是一种强酸性剧毒物质,常温下,纯净的N2O4是无色气体,可溶于水,且与水反应生成两种含氧酸,该反应的化学方程式是:N2O4+H2O=HNO3+HNO2,对上述反应中的各种物质,下列说法正确的是D.
A.N2O4只做氧化剂
B.产物中两种酸都是强酸
C.反应中水只做溶剂
D.N2O4泄漏后可产生红棕色气体
(3)发射航天火箭另一常用燃料是氮的氢化物(N2H4),N2H4燃烧时用NO2做氧化剂,它们相互反应生成氮气和水蒸气.
已知:
N2(g)+2O2(g)=2NO(g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
则N2H4(g)和NO2(g)反应生成氮气和水蒸气的热化学方程式为2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;当该反应中转移0.8mol电子时,理论上消耗N2H4(g)在标准状况下是4.48L.
分析 (1)C2H8N2中的N元素的化合价由-3价升高为0,C元素的化合价由-1价升高为+4价,故一个C2H8N2参与反应化合价升高16,N2O4中的N元素化合价由+4价降低为0,故一个N2O4参与反应化合价降低8,结合电子守恒及质量守恒定律解答;
(2)N2O4是无色气体,可溶于水,且与水反应生成两种含氧酸,由反应物可知两种含氧酸必定都是含氮的含氧酸,再根据化合价变化书写化学方程式;
(3)依据盖斯定律结合已知热化学方程式计算并结合热化学方程式书写方法书写;该反应2N2H4+2NO2=3N2+4H2O中,2N2H4→2N2,N元素由-2价→0价,所以反应2molN2H4,转移8mol电子.
解答 解:(1)C2H8N2中的N元素的化合价由-3价升高为0,C元素的化合价由-1价升高为+4价,故一个C2H8N2参与反应化合价升高16,N2O4中的N元素化合价由+4价降低为0,故一个N2O4参与反应化合价降低8,结合电子守恒所以C2H8N2前为1,N2O4前为2,则氮气前为3二氧化碳前为2,最后根据原子守恒补上4个水,反应为C2H8N2+2N2O4=3N2↑+2CO2↑+4H2O↑,
故答案为:1;2;3; 2;4H2O;
(2)N2O4是无色气体,可溶于水,且与水反应生成两种含氧酸,由反应物可知两种含氧酸必定都是含氮的含氧酸,又N2O4的氮+4和水反应刚好一个升高到+5的硝酸,一个降低到+3的亚硝酸,故反应方程式为:N2O4+H2O=HNO3+HNO2;根据以上分析A.N2O4只做氧化剂错误,C.反应中水只做溶剂错误;B.产物中两种酸都是强酸,因为亚硝酸是弱酸也错误;D.N2O4泄漏后可产生红棕色气体,由于存在N2O4?2NO2平衡所以D正确;
故答案为:N2O4+H2O=HNO3+HNO2;D;
(3)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
依据盖斯定律,②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
该反应2N2H4+2NO2=3N2+4H2O中,2N2H4→2N2,N元素由-2价→0价,所以反应2molN2H4,转移8mol电子,所以当该反应中转移0.8mol电子时,理论上消耗N2H4(g)在标准状况下0.2mol×22.4L/mol=4.48L,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;4.48.
点评 本题主要考查了氧化还原反应的方程式书写、计算,热化学方程式的书写等知识,题目难度中等,注意盖斯定律的应用.

 阅读快车系列答案
阅读快车系列答案(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ•mol-1):
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)═CF4(g)+4HF(g)△H=-1928kJ/mol.
(3)下列说法不正确的是(填序号)AD
A.某温度下纯水中的C(H+)=10-6,故其显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.相同温度下,0.1mol•L-1NH4Cl溶液中NH4+的浓度比0.1mol•L-1氨水中NH4+的浓度大;
D.相同温度下,PH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大;
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小.
| A. | 150mL 1mol•L-1的NaCl | B. | 25mL 2mol•L-1的FeCl3 | ||
| C. | 150mL 3mol•L-1的KCl | D. | 75mL 2mol•L-1的CaCl2 |
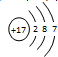 ,C的离子结构示意图
,C的离子结构示意图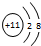 .
. .
.