题目内容
16.甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.已知某些化学键的键能数据如下表:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1molCO和 2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(3)下列描述中能说明上述反应已达平衡的是BC;
A.2v(H2)正=v(CH3OH)逆 B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变 D.单位时间内生成 n molCO 的同时生成 2n molH2.
分析 (1)依据化学反应焓变=反应物键能总和-生成物键能总和计算,标注物质聚集状态和对应反应的焓变写出热化学方程式;
(2)通过(1)写出的热化学方程式可知反应是气体体积减小的放热反应,当减小到20min时反应达到平衡状态,依据反应速率概念V=$\frac{△c}{△t}$计算速率,平衡常数是利用平衡状态下生成物浓度幂次方乘积除以反应物浓度的幂次方乘积得到;对于放热反应,温度升高,化学平衡常数会减小;
(3)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断.
解答 解:(1)CO(g)+2H2(g)?CH3OH (g),反应的焓变可以根据反应物的总键能和生成物的总键能计算得到,焓变=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能计算得到,)△H1═1072KJ/mol+2×436KJ/mol-(3×413KJ/mol+358KJ/mol+463KJ/mol)=-116 kJ•mol-1,热化学方程式CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1,
故答案为:CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1;
(2)从反应开始到20min时,设CO的浓度变化量是x,
CO(g)+2H2(g)?CH3OH(g)
初始浓度:0.5 1 0
变化浓度:x 2x x
平衡浓度:0.5-x 1-2x x
根据反应前后压强之比等于物质的量之比,则$\frac{3}{3-4x}$=$\frac{12.6}{8.4}$,解得x=0.25mol/L,
从反应开始到20min时,以CO表示的平均反应速率v=$\frac{△c}{△t}$=$\frac{0.25mol/L}{20min}$=0.0125mol/(L•min),
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.25mol/L}{0.25mol/L×(0.5mol/L)^{2}}$=4(mol/L)-2,
对于该放热反应,温度升高,化学平衡常数会减小;
故答案为:0.0125mol/(L•min);4(mol/L)-2;减小;
(3)反应是气体体积减小的放热反应,则
A、v(H2)正=2v(CH3OH)逆才能说明正逆反应速率相等,化学反应达到平衡,故A错误;
B、容器内气体的平均摩尔质量等于总质量除以总物质的量,质量是守恒的保持不变,但是n变化,当气体的平均摩尔质量不变了,证明达到平衡,故B正确;
C、反应是前后气体体积变化的反应,容器中气体的压强保持不变,证明达到了平衡,故C正确;
D、单位时间内生成nmolCO的同时生成2nmolH2,不能说明正逆反应速率相等,不一定平衡,故D错误.
故选BC.
点评 本题涉及化学反应的焓变和化学键键能之间的关系、化学反应速率和平衡、等效平衡以及化学平衡的有关计算知识,综合性强,难度中等.

 名校课堂系列答案
名校课堂系列答案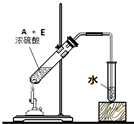 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶. | 其产量用来衡量一个国家的石油化工水平. | 比例模型为: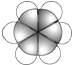 | ①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体. | 由5个原子组成的10个电子的共价分子. |
①有毒 ②无色无味 ③密度比水小 ④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤B.②③④C.③④⑥D.④⑤⑥
(2)B的电子式为
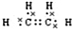 ,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)(3)工业上,D来源于煤干馏(填操作名称)后的液态产物煤焦油.D在浓硫酸、50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为
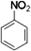 .
.(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件).
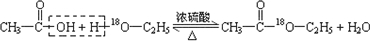 .
.如图为实验室进行该反应时的装置图,其中有4处错误.
| A. | 化合反应 | B. | 氧化还原反应 | C. | 置换反应 | D. | 分解反应 |
(2)下表中的数据表示破坏1mol化学键需消耗的能量(即键能,单位为kJ•mol-1):
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
CH4(g)+4F2(g)═CF4(g)+4HF(g)△H=-1928kJ/mol.
(3)下列说法不正确的是(填序号)AD
A.某温度下纯水中的C(H+)=10-6,故其显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小;
C.相同温度下,0.1mol•L-1NH4Cl溶液中NH4+的浓度比0.1mol•L-1氨水中NH4+的浓度大;
D.相同温度下,PH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大;
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小.
| A. | 150mL 1mol•L-1的NaCl | B. | 25mL 2mol•L-1的FeCl3 | ||
| C. | 150mL 3mol•L-1的KCl | D. | 75mL 2mol•L-1的CaCl2 |
 实验室欲配制980mL0.100mol•L-1Na2CO3溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平
实验室欲配制980mL0.100mol•L-1Na2CO3溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平
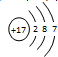 ,C的离子结构示意图
,C的离子结构示意图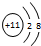 .
. .
.