题目内容
6.用一种试剂将下列各组物质鉴别开.(1)
 和
和 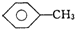 :KMnO4(H+)溶液
:KMnO4(H+)溶液(2)
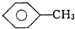 ,CCl4和乙醇:水.
,CCl4和乙醇:水.
分析 (1)甲苯可与酸性高锰酸钾发生氧化还原反应;
(2)甲苯、四氯化碳都不溶于水,但二者密度不同,乙醇易溶于水.
解答 解:(1)苯性质稳定,与高锰酸钾不反应,但甲苯可与酸性高锰酸钾发生氧化还原反应,则可用KMnO4(H+)溶液鉴别,故答案为:KMnO4(H+)溶液;
(2)甲苯、四氯化碳都不溶于水,但二者密度不同,甲苯的密度比水小,四氯化碳的密度比水大,乙醇易溶于水,可加入水鉴别,故答案为:水.
点评 本题考查有机物的鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握有机物的性质的异同,难度不大.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
1.设NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,48g O3含有的氧原子数为3NA | |
| B. | 17g的OH-离子中含有的电子数为0.1NA | |
| C. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
2.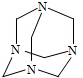 乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
 乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示.将甲醛水溶液与氨水混合蒸发可制得乌洛托品.若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 2:1 |
14.用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
| A. | NH4+为正四面体形 | B. | CS2为直线形 | ||
| C. | HCN为折线形(V形) | D. | PCl3为三角锥形 |
1.气态烃A100mL,最多可与200mLHCl气体发生加成反应生成B,1molB最多可与4mol氯气发生取代反应,则A为( )
| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCH3 | D. | CH3C≡CH |
11.下列叙述正确的是( )
| A. | 分子中一定含有化学键 | |
| B. | 共价化合物一定不含有离子键 | |
| C. | 含有金属元素的离子一定是阳离子 | |
| D. | 非金属元素的化合物一定不含有离子键 |
15.室温时,0.01mol•L-1某一元弱酸的电离度为 1%,则下列说法正确的是( )
| A. | 上述弱酸溶液的 pH=4 | |
| B. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH=7 | |
| C. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH>7 | |
| D. | 加入等体积 0.01mol•L-1NaOH 溶液后,所得溶液的 pH<7 |
16.某课外小组研究Fe3+与I-发生反应的速度关系和平衡移动原理的应用.
(1)写FeCl3溶液和KI溶液的离子方程式:2Fe3++2I-=2Fe2++I2.
(2)在其他条件不变时,上述反应达到平衡后,取2mL,平衡混合物加入2mL苯充分振荡萃取(填操作名称).所看到的实验现象是分层,上层为紫色(浅紫色到紫红色均可),下层接近无色,化学平衡将向正反应方向(或右)移动.
(3)由于Fe3+与I2水的稀溶液颜色接近,肉眼比较难区分上述反应是否发生,如果要看到发生反应则应有的操作及实验现象是取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色.该小组同学希望通过鉴别Fe2+得到目的,取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀.该反应的离子方程式为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
(4)Fe3+与I-发生反应的正反应速率v与c(Fe3+)和c(I-)的关系为v=kcm(Fe3+)cn(I-)(k为常数)
通过表中数据计算的m=1;n=2.
(5)现有0.10mol•L-1 FeCl3溶液和0.10mol•L-1 KI溶液各2mL在试管中充分反应达到平衡,测得平衡时c(Fe3+)变为0.01mol•L-1,没有碘固体析出,试计算此条件下该反应的平衡常数K=3.2×103.
(1)写FeCl3溶液和KI溶液的离子方程式:2Fe3++2I-=2Fe2++I2.
(2)在其他条件不变时,上述反应达到平衡后,取2mL,平衡混合物加入2mL苯充分振荡萃取(填操作名称).所看到的实验现象是分层,上层为紫色(浅紫色到紫红色均可),下层接近无色,化学平衡将向正反应方向(或右)移动.
(3)由于Fe3+与I2水的稀溶液颜色接近,肉眼比较难区分上述反应是否发生,如果要看到发生反应则应有的操作及实验现象是取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色.该小组同学希望通过鉴别Fe2+得到目的,取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀.该反应的离子方程式为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
(4)Fe3+与I-发生反应的正反应速率v与c(Fe3+)和c(I-)的关系为v=kcm(Fe3+)cn(I-)(k为常数)
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
(5)现有0.10mol•L-1 FeCl3溶液和0.10mol•L-1 KI溶液各2mL在试管中充分反应达到平衡,测得平衡时c(Fe3+)变为0.01mol•L-1,没有碘固体析出,试计算此条件下该反应的平衡常数K=3.2×103.
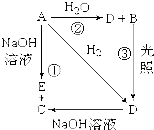 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.