��Ŀ����
5����O2��HClת��ΪCl2�������Ч�棬������Ⱦ��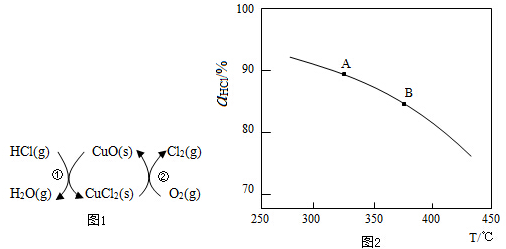
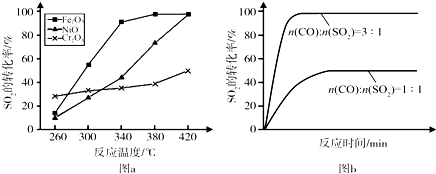
��1����ͳ�ϸ�ת��ͨ����ͼ1��ʾ�Ĵ�ѭ��ʵ�֣����У���Ӧ��Ϊ��2HCl��g��+CuO��s��?H2O��g��+CuCl2��s����H1����Ӧ������1molCl2��g���ķ�Ӧ��Ϊ��H2�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2������Ӧ���á�H1�͡�H2��ʾ����
��2������RuO2����������HClת��ΪCl2���ܷ�Ӧ���и��õĴ����ԣ�
��ʵ������һ��ѹǿ�£��ܷ�Ӧ��HClƽ��ת�������¶ȱ仯�Ħ�HCl��T������ͼ2�����ܷ�Ӧ�ġ�H��0�����������=����������A��B�����ƽ�ⳣ��K��A����K��B���нϴ����K��A����
��������ʵ������ѹ�����ʹѹǿ��������Ӧ��HCl��T���ߵ�ʾ��ͼ������Ҫ˵�����ɣ�����ѹǿ��ƽ��������Ӧ�����ƶ�����HCl������ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�
�����д�ʩ�У���������ߦ�HCl����BD��
A������n��HCl�� B������n��O2��
C��ʹ�ø��õĴ��� D����ȥH2O
��3��һ�������²�÷�Ӧ������n��Cl2�����������£�
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n��Cl2��/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
��4��Cl2��;�㷺��д����Cl2�Ʊ�Ư�۵Ļ�ѧ��Ӧ����ʽ2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
���� ��1����ͼʾ��֪����������Ϊ��4HCl+O2=2Cl2+2H2O����Ӧ������1molCl2��g���ķ�Ӧ��Ϊ��H2����Ӧ�Ȼ�ѧ����ʽΪ��CuCl2��g��+$\frac{1}{2}$O2��g��=CuO��s��+Cl2��g����H2�����ݸ�˹���ɣ���+�ڣ���2�ɵ��ܷ�Ӧ���Ȼ�ѧ����ʽ��
��2������ͼ��֪���¶�Խ�ߣ�ƽ��ʱHCl��ת����ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���
������ӦΪ���������С�ķ�Ӧ������ѹǿ��ƽ��������Ӧ�����ƶ�����ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�
�۸ı��ʩ��������ߦ�HCl��Ӧʹƽ��������Ӧ�����ƶ���ע�ⲻ��ֻ����HCl��Ũ�ȣ�
��3������v=$\frac{��n}{��t}$����2.0��6.0min��v��Cl2��������������֮�ȵ����仯ѧ������֮�ȼ���v��HCl����
��4���������������Ʒ�Ӧ�����Ȼ��ơ����������ˮ��
��� �⣺��1����ͼʾ��֪����������Ϊ��4HCl+O2=2Cl2+2H2O����Ӧ��Ϊ��2HCl��g��+CuO��s��?H2O��g��+CuCl2��s����H1��
��Ӧ������1molCl2��g���ķ�Ӧ��Ϊ��H2����Ӧ�Ȼ�ѧ����ʽΪ��CuCl2��g��+$\frac{1}{2}$O2��g��=CuO��s��+Cl2��g����H2��
���ݸ�˹���ɣ���+�ڣ���2�ɵ��ܷ�Ӧ���Ȼ�ѧ����ʽ��4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2����
�ʴ�Ϊ��4HCl��g��+O2��g��=2Cl2��g��+2H2O��g����H=2����H1+��H2����
��2������ͼ��֪���¶�Խ�ߣ�ƽ��ʱHCl��ת����ԽС��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ������H��0����ѧƽ�ⳣ����С����K��A����K��B����
�ʴ�Ϊ������K��A����
������ӦΪ���������С�ķ�Ӧ������ѹǿ��ƽ��������Ӧ�����ƶ�����ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�ѹ�����ʹѹǿ������Ӧ��HCl��T���ߵ�ʾ��ͼΪ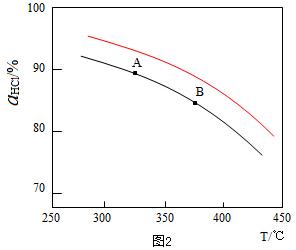 ��
��
�ʴ�Ϊ�� ������ѹǿ��ƽ��������Ӧ�����ƶ�����HCl������ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�
������ѹǿ��ƽ��������Ӧ�����ƶ�����HCl������ͬ�¶���HCl��ƽ��ת���ʱ�֮ǰʵ��Ĵ�
��A������n��HCl����HClŨ������ƽ�����ƣ���HCl��ת���ʽ��ͣ���A����
B������n��O2��������Ũ������ƽ�����ƣ�HCl��ת������ߣ���B��ȷ��
C��ʹ�ø��õĴ������ӿ췴Ӧ���ʣ����̵���ƽ���ʱ�䣬��Ӱ��ƽ���ƶ���HCl��ת���ʲ��䣬��C����
D����ȥ������H2O��������ƽ�����ƣ�HCl��ת��������D��ȷ��
��ѡ��BD��
��3���ɱ������ݿ�֪��2.0��6.0min�ڡ�n��Cl2��=��5.4-1.8����10-3mol=3.6��10-3mol������Cl2�����ʵ����仯��ʾ�ķ�Ӧ����v��Cl2��=$\frac{3.6��1{0}^{-3}}{6min-2min}$=9��10-4mol•min-1������֮�ȵ����仯ѧ������֮�ȣ���v��HCl��=2v��Cl2��=1.8��10-3mol��min-1��
��2.0��6.0min����HCl�����ʵ����仯��ʾ�ķ�Ӧ����1.8��10-3mol•min-1��
��4���������������Ʒ�Ӧ�����Ȼ��ơ����������ˮ����Ӧ����ʽΪ2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
�ʴ�Ϊ��2Cl2+2Ca��OH��2=CaCl2+Ca��ClO��2+2H2O��
���� ����Ƚ��ۺϣ��漰�Ȼ�ѧ����ʽ��д����ѧƽ�⼰ƽ�ⳣ��Ӱ�����ء���ѧ��Ӧ���ʵļ���ȣ���3����ע���õ�λʱ�������ʵ����仯��ʾ���ʣ��ϺõĿ���ķ������������������Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ����������Һ�� pH=4 | |
| B�� | �������� 0.01mol•L-1NaOH ��Һ��������Һ�� pH=7 | |
| C�� | �������� 0.01mol•L-1NaOH ��Һ��������Һ�� pH��7 | |
| D�� | �������� 0.01mol•L-1NaOH ��Һ��������Һ�� pH��7 |
��1��дFeCl3��Һ��KI��Һ�����ӷ���ʽ��2Fe3++2I-=2Fe2++I2��
��2����������������ʱ��������Ӧ�ﵽƽ���ȡ2mL��ƽ���������2mL���������ȡ����������ƣ�����������ʵ�������Ƿֲ㣬�ϲ�Ϊ��ɫ��dz��ɫ���Ϻ�ɫ���ɣ����²�ӽ���ɫ����ѧƽ�⽫������Ӧ�����ң��ƶ���
��3������Fe3+��I2ˮ��ϡ��Һ��ɫ�ӽ������۱Ƚ�������������Ӧ�Ƿ��������Ҫ����������Ӧ��Ӧ�еIJ�����ʵ��������ȡ������Ӧ�����Һ��С�Թ��У��μӵ�����Һ���ɹ۲쵽��Һ����ɫ����С��ͬѧϣ��ͨ������Fe2+�õ�Ŀ�ģ�ȡ������2�λ�ɫK3[Fe��CN��6]�����軯�أ���Һ�����ɴ���������ɫ�����軯�����������÷�Ӧ�����ӷ���ʽΪ3Fe2++2[Fe��CN��6]3-�TFe3[Fe��CN��6]2����
��4��Fe3+��I-������Ӧ������Ӧ����v��c��Fe3+����c��I-���Ĺ�ϵΪv=kcm��Fe3+��cn��I-����kΪ������
| C��Fe3+��/mol•L-1 | c��I-��/mol•L-1 | v/mol•L-1•s-1 | |
| �� | 0.80 | 0.20 | 0.032k |
| �� | 0.40 | 0.60 | 0.144k |
| �� | 0.20 | 0.80 | 0.128k |
��5������0.10mol•L-1 FeCl3��Һ��0.10mol•L-1 KI��Һ��2mL���Թ��г�ַ�Ӧ�ﵽƽ�⣬���ƽ��ʱc��Fe3+����Ϊ0.01mol•L-1��û�е�����������Լ���������¸÷�Ӧ��ƽ�ⳣ��K=3.2��103��
| A�� | 23gNa������H2O��Ӧ��ȫ�������NA��H2���� | |
| B�� | 1molCu��������Ũ���ᷴӦ������NA��SO3���� | |
| C�� | ��״���£�22.4LN2��H2������к�NA��ԭ�� | |
| D�� | 3mol����Fe��ȫת��ΪFe3O4��ʧȥ8NA������ |
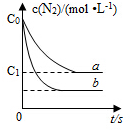 �����ʵ�����N2��g����O2��g���ں����ܱ������з�Ӧ��N2��g��+O2��g��?2NO��g������ͼ����a��ʾ�÷�Ӧ��T��ʱN2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�������
�����ʵ�����N2��g����O2��g���ں����ܱ������з�Ӧ��N2��g��+O2��g��?2NO��g������ͼ����a��ʾ�÷�Ӧ��T��ʱN2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ���ǣ�������| A�� | T��ʱ���÷�Ӧ��ƽ�ⳣ��K=$\frac{4��{c}_{0}-{c}_{1}��^{2}}{{{c}_{1}}^{2}}$ | |
| B�� | T��ʱ�����ŷ�Ӧ�Ľ��У����������ܶȼ�С | |
| C�� | ����b��Ӧ�������ı�����Ǽ����˴��� | |
| D�� | ������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ�ġ�H��0 |
| A�� | 60g�����д��ڵĹ��ۼ�����Ϊ10NA | |
| B�� | 1L 0.1mol•L-1��NaHCO3��Һ��HCO3-��CO32-������֮��Ϊ0.1NA | |
| C�� | ���ڿ�����ȼ�տ����ɶ��������23g�Ƴ��ȼ��ʱת�Ƶ�����Ϊ1NA | |
| D�� | 235g����92235U�����ѱ䷴Ӧ��92235U+01n$\stackrel{�ѱ�}{��}$3890Sr+54136Xe+1001n�����������ӣ�01n����Ϊ10NA |
| ���� |  |  | |
| ���� | Fe�������������ɫ���ݣ�Һ���Ϸ���Ϊ����ɫ | Fe���������������ɫ���ݺ�Ѹ��ֹͣ | Fe��Cu�Ӵ�����������������ɫ���� |
| A�� | ������������ɫ�����ɫ�Ļ�ѧ����ʽ��2NO+O2�T2NO2 | |
| B�� | ���е�����˵��Fe�����γ����ܵ������㣬��ֹFe��һ����Ӧ | |
| C�� | �Դˢ�������˵��ϡHNO3��������ǿ��ŨHNO3 | |
| D�� | ��Ԣ���������Fe��Cu֮�����ӵ����ƣ����ж�Fe�Ƿ����� |
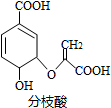
| A�� | �����к���2�ֹ����� | |
| B�� | �����Ҵ������ᷴӦ���ҷ�Ӧ������ͬ | |
| C�� | 1mol��֦��������3molNaOH�����кͷ�Ӧ | |
| D�� | ��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ |