题目内容
11.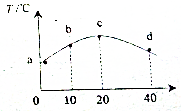 若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
若往20mL 0.01mol•L-1的HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )| A. | HNO2的电离平衡常数:c点>b点 | |
| B. | 若b点混合溶液显酸性,则2c(Na+)=c(NO2-)+c(HNO2) | |
| C. | c点混合溶液中:c(Na+)>c(OH-)>c(NO2)>c(H+) | |
| D. | d点混合溶液中:c(OH-)=c(HNO2)+c(H+) |
分析 根据当加入20mLNaOH溶液时,溶液的温度最高,则说明此时NaOH和HNO2恰好完全反应,故C(NaOH)=0.01mol/L.
A、HNO2的电离是吸热过程,温度越高电离平衡常数越大;
B、b点时,加入的n(NaOH)=$\frac{1}{2}$n(HNO2),根据物料守恒来分析;
C、c点溶液中,n(NaOH)=n(HNO2),两者恰好完全反应生成NaNO2,为强碱弱酸盐,据此分析;
D、在d点溶液中,NaOH过量,溶液中n(NaOH)=n(NaNO2),根据电荷守恒和物料守恒来分析.
解答 解:根据当加入20mLNaOH溶液时,溶液的温度最高,则说明此时NaOH和HNO2恰好完全反应,故C(NaOH)=0.01mol/L.
A、HNO2的电离是吸热过程,温度越高电离平衡常数越大,而c高于b,所以电离平衡常数:c点>b点,故A正确;
B、b点时,加入的n(NaOH)=$\frac{1}{2}$n(HNO2),HNO2反应后部分反应为NaNO2,即溶液中含有HNO2和NaNO2,但无论以哪种形式存在,均满足物料守恒,即有:2c(Na+)=c(NO2-)+c(HNO2),故B正确;
C、c点溶液中,加入的氢氧化钠的物质的量n(NaOH)=n(HNO2),两者恰好完全反应生成NaNO2,为强碱弱酸盐,NO2-存在微弱的水解,溶液显碱性,故有:c(Na+)>c(NO2-)>c(OH-)>c(H+),故C错误;
D、在d点溶液中,加入的氢氧化钠的物质的量是HNO2的物质的量的2倍,即n(NaOH)=2n(HNO2),反应后,溶液中的C(NaOH)=C(NaNO2);则反应后溶液中存在电荷守恒:c(Na+)+c(H+)=c(NO2-)+c(OH-) ①
还存在物料守恒:c(Na+)=2c(NO2-)+2c(HNO2) ②
将①-②可得:c(OH-)=c(H+)+c(NO2-)+2c(HNO2),故D错误.
故选CD.
点评 本题是根据图象分析离子的浓度之间的关系,解题的关键是根据图象中温度的变化来确定,确定物质的反应实质是解题的关键.

| A. | CH2=CH2 | B. | CH≡CH | C. | CH2=CHCH3 | D. | CH3C≡CH |
| A. | A=1×10-4B | B. | B=1×10-4A | C. | A>B | D. | A=B |
(1)写FeCl3溶液和KI溶液的离子方程式:2Fe3++2I-=2Fe2++I2.
(2)在其他条件不变时,上述反应达到平衡后,取2mL,平衡混合物加入2mL苯充分振荡萃取(填操作名称).所看到的实验现象是分层,上层为紫色(浅紫色到紫红色均可),下层接近无色,化学平衡将向正反应方向(或右)移动.
(3)由于Fe3+与I2水的稀溶液颜色接近,肉眼比较难区分上述反应是否发生,如果要看到发生反应则应有的操作及实验现象是取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色.该小组同学希望通过鉴别Fe2+得到目的,取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀.该反应的离子方程式为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
(4)Fe3+与I-发生反应的正反应速率v与c(Fe3+)和c(I-)的关系为v=kcm(Fe3+)cn(I-)(k为常数)
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
(5)现有0.10mol•L-1 FeCl3溶液和0.10mol•L-1 KI溶液各2mL在试管中充分反应达到平衡,测得平衡时c(Fe3+)变为0.01mol•L-1,没有碘固体析出,试计算此条件下该反应的平衡常数K=3.2×103.
| A. | 在碱性溶液中,Na+、S2-、K+、AlO2- | |
| B. | 在酸性溶液中,SO32-、S2-、K+、NH4+ | |
| C. | 在酸性溶液中,Fe2+、Cu2+、Cl-、NO3- | |
| D. | 在酸性溶液中,Fe2+、Cl-、Na+、SO42- |
| A. | 23gNa与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 标准状况下,22.4LN2和H2混合气中含NA个原子 | |
| D. | 3mol单质Fe完全转化为Fe3O4,失去8NA个电子 |
| A. | 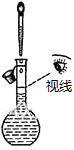 配置一定浓度的NaCl溶液 | B. | 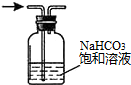 除去氯气中的HCl气体 | ||
| C. | 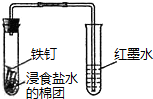 观察铁的吸氧腐蚀 | D. | 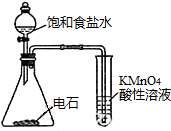 检验乙炔的还原性 检验乙炔的还原性 |