题目内容
6.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 烧结粘土制陶瓷 | D. | 打磨磁石制指南针 |
分析 A.胆矾的化学式为CuSO4•5H2O,整个过程中Cu元素由化合态转化为单质,一定发生化学变化;
B.铁矿石主要成份为Fe2O3,炼铁得到Fe单质,有新物质生成,属于化学反应;
C.制陶瓷的原料是粘土,发生化学变化生成硅酸盐产品;
D.打磨磁石制指南针,只是改变物质的外形,没有新物质生成.
解答 解:A.胆矾的化学式为CuSO4•5H2O,由CuSO4•5H2O→Cu,有新物质生成,属于化学反应,故A不选;
B.铁矿石主要成份为Fe2O3,由Fe2O3→Fe,有新物质生成,属于化学反应,故B不选;
C.制陶瓷的原料是粘土,发生化学变化生成硅酸盐产品,故C不选;
D.打磨磁石制指南针,只是改变物质的外形,没有新物质生成,不涉及化学反应,故选D;
故选D.
点评 本题考查化学反应的判断,比较基础,明确原理是解题关键,A、B选项可以借助化合价变价,利用氧化还原反应知识判断.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
16.某课外小组研究Fe3+与I-发生反应的速度关系和平衡移动原理的应用.
(1)写FeCl3溶液和KI溶液的离子方程式:2Fe3++2I-=2Fe2++I2.
(2)在其他条件不变时,上述反应达到平衡后,取2mL,平衡混合物加入2mL苯充分振荡萃取(填操作名称).所看到的实验现象是分层,上层为紫色(浅紫色到紫红色均可),下层接近无色,化学平衡将向正反应方向(或右)移动.
(3)由于Fe3+与I2水的稀溶液颜色接近,肉眼比较难区分上述反应是否发生,如果要看到发生反应则应有的操作及实验现象是取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色.该小组同学希望通过鉴别Fe2+得到目的,取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀.该反应的离子方程式为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
(4)Fe3+与I-发生反应的正反应速率v与c(Fe3+)和c(I-)的关系为v=kcm(Fe3+)cn(I-)(k为常数)
通过表中数据计算的m=1;n=2.
(5)现有0.10mol•L-1 FeCl3溶液和0.10mol•L-1 KI溶液各2mL在试管中充分反应达到平衡,测得平衡时c(Fe3+)变为0.01mol•L-1,没有碘固体析出,试计算此条件下该反应的平衡常数K=3.2×103.
(1)写FeCl3溶液和KI溶液的离子方程式:2Fe3++2I-=2Fe2++I2.
(2)在其他条件不变时,上述反应达到平衡后,取2mL,平衡混合物加入2mL苯充分振荡萃取(填操作名称).所看到的实验现象是分层,上层为紫色(浅紫色到紫红色均可),下层接近无色,化学平衡将向正反应方向(或右)移动.
(3)由于Fe3+与I2水的稀溶液颜色接近,肉眼比较难区分上述反应是否发生,如果要看到发生反应则应有的操作及实验现象是取少量反应后的溶液于小试管中,滴加淀粉溶液,可观察到溶液变蓝色.该小组同学希望通过鉴别Fe2+得到目的,取样加入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,生成带有特征蓝色的铁氰化亚铁沉淀.该反应的离子方程式为3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
(4)Fe3+与I-发生反应的正反应速率v与c(Fe3+)和c(I-)的关系为v=kcm(Fe3+)cn(I-)(k为常数)
| C(Fe3+)/mol•L-1 | c(I-)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.80 | 0.20 | 0.032k |
| ② | 0.40 | 0.60 | 0.144k |
| ③ | 0.20 | 0.80 | 0.128k |
(5)现有0.10mol•L-1 FeCl3溶液和0.10mol•L-1 KI溶液各2mL在试管中充分反应达到平衡,测得平衡时c(Fe3+)变为0.01mol•L-1,没有碘固体析出,试计算此条件下该反应的平衡常数K=3.2×103.
17.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物.23g钠充分燃烧时转移电子数为1NA | |
| D. | 235g核素92235U发生裂变反应:92235U+01n$\stackrel{裂变}{→}$3890Sr+54136Xe+1001n净产生的中子(01n)数为10NA |
14.在通风橱中进行下列实验:
下列说法不正确的是( )
| 步骤 |  |  | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 | |
| D. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 |
1.下列操作或装置能达到实验目的是( )
| A. | 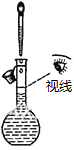 配置一定浓度的NaCl溶液 | B. | 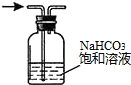 除去氯气中的HCl气体 | ||
| C. | 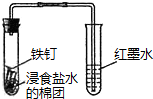 观察铁的吸氧腐蚀 | D. | 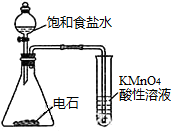 检验乙炔的还原性 检验乙炔的还原性 |
11.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1
已知:
碳的燃烧热△H1=a kJ•mol-1
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=x kJ•mol-1
已知:
碳的燃烧热△H1=a kJ•mol-1
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1
则x为( )
| A. | 3a+b-c | B. | c-3a-b | C. | a+b-c | D. | c-a-b |
18.纯净物X、Y、Z转化关系如图所示,下列判断正确的是( )


| A. | X可能是金属铜 | B. | Y不可能是氢气 | C. | Z可能是氯化钠 | D. | Z可能是三氧化硫 |
15.分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )


| A. | 分子中含有2种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
13.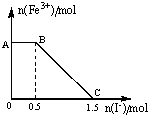 将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
 将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )| A. | 图中AB段发生的是过量的酸性KMnO4溶液与KI的反应 | |
| B. | 从题中可以得出还原性:I->Fe2+>Mn2+ | |
| C. | 取B点以后的少量溶液滴入几滴KSCN溶液,溶液变红色 | |
| D. | 根据OC段的数据可知,开始加入的KMnO4的物质的量为0.5mol |