题目内容
9.下列有关化学用语正确的是( )| A. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | (CH3)2C=CHCH2CH3分子中的六个碳原子中至少有五个在同一个平面上 | |
| D. | 苯分子的比例模型: |
分析 A.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
B.液化石油气主要成分为丙烷、丁烷、丙烯、丁烯等;
C.乙烯是平面结构;
D.比例模型主要体现的是组成该分子的原子间的大小关系.
解答 解:A.乙醇、乙二醇与丙三醇所含羟基的个数不同,不为同系物,故A错误;
B.液化石油气主要成分为丙烷、丁烷、丙烯、丁烯等,天然气的主要成分为甲烷,故B错误;
C.乙烯是平面结构,取代乙烯中氢原子的碳原子和乙烯共平面,故C正确;
D.比例模型主要体现的是组成该分子的原子间的大小关系,碳原子半径大于氢原子,所以苯的比例模型是 ,故D正确;故选CD.
,故D正确;故选CD.
点评 本题考查同系物、同分异构体常见有机物的成分和结构,题目难度不大,注意掌握乙烯的平面结构是解决本题的关键.

练习册系列答案
相关题目
19.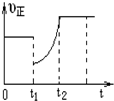 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变 | |
| D. | 图象中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 |
4.下列说法正确的是( )
| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,在含Cl-、CrO42-浓度相同的溶液中逐滴滴加稀AgNO3溶液时,则先生成AgCl沉淀 | |
| C. | 某晶体中,有金属阳离子一定有阴离子 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
14.下列反应的离子方程式中,不正确的是( )
| A. | 用碳棒作电极电解硫酸铜溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| C. | Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH-+2H++SO${\;}_{4}^{2-}$═BaSO4↓+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O$\stackrel{通电}{→}$C6H5OH+HCO${\;}_{3}^{-}$ |
1.常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
| A. | 同温度同物质的量浓度时,HF比HCN酸性强,则同浓度的NaF溶液的 pH 比 NaCN 溶液大 | |
| B. | 0.1mol•L-1的NH4Cl溶液与0.1mol•L-1的NaOH溶液等体积混合后,得到pH>7的溶液中:c(Cl-)=c(Na+)>c(NH4+ )>c(OH-)>c(H+) | |
| C. | 相同物质的量浓度的下列溶液中,①NH4Al(SO2)2、②(NH4)2SO4、③CH3COONH4、④NH3•H2O;其中c(NH${\;}_{4}^{+}$) 由大到小的顺序是:①>②>③>④ | |
| D. | PH=11的Na2CO3溶液中:c(Na+)-2c(CO${\;}_{3}^{2-}$)-c(HCO${\;}_{3}^{-}$)=10-3-10-11 |
18.以下表示物质通过一步反应的转化关系,下列说法正确的是( )
X$\stackrel{O_{2}}{→}$酸性氧化物→还原性盐.
X$\stackrel{O_{2}}{→}$酸性氧化物→还原性盐.
| A. | X可能是Si单质 | B. | X可能是含S元素的化合物 | ||
| C. | 酸性氧化物可能为CO2 | D. | 还原性盐可能为FeCl3 |
18.实验室可用下列方法制取气体,其中必须用排水法的是( )
| A. | 铜片与稀硝酸共热 | B. | 二氧化锰与盐酸共热 | ||
| C. | 锌与稀硫酸共热 | D. | 稀盐酸与碳酸钙的反应 |




 .
.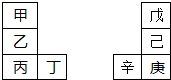 甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,
甲~辛等元素在周期表中的相对位置如图.甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,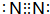 ,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.
,写出一种含戊、己两种元素的离子化合物的化学式(NH4)3PO4或(NH4)2HPO4、NH4H2PO4.