题目内容
19.硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸、硫代硫酸(H2S2O3)等,其中硫酸最为重要,在工业上有广泛的应用.完成下列计算:
(1)浓硫酸与铜在加热时发生反应,生成二氧化硫气体的体积为4.48L(标准状况),若将反应后的溶液稀释至500mL,该溶液中硫酸铜的物质的量浓度为0.4mol•L-1;
(2)焦硫酸(H2SO4•SO3)溶于水,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为1.25mol•L-1.
分析 (1)铜和浓硫酸的反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+SO2↑,根据硫酸铜和二氧化硫的关系式计算硫酸铜的物质的量;根据稀释前后溶质的物质的量不变计算稀释后硫酸铜的浓度;
(2)根据焦硫酸(H2SO4•SO3)溶于水,其中SO3都转化为硫酸,即n(H2SO4)=2n(H2SO4•SO3),结合公式c=$\frac{n}{V}$来求硫酸的物质的量浓度.
解答 解:(1)设硫酸铜的物质的量为n,
Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+SO2↑
1mol 22.4L
n(CuSO4) 4.48L
$\frac{1mol}{n}=\frac{22.4L}{4.48L}$,所以n(CuSO4)=$\frac{1mol×4.48L}{22.4L/mol}$=0.2mol,溶液稀释前后溶质的物质的量不变,所以c(CuSO4)=$\frac{0.2mol}{0.5L}$=0.4mol/L,
故答案为:0.4;
(2)n(H2SO4)=2n(H2SO4•SO3)=$\frac{445g}{178g/mol}$×2=5mol,所以该硫酸的物质的量浓度为c(H2SO4)=$\frac{5mol}{4.00L}$=1.25mol/L,
故答案为:1.25.
点评 本题考查了根据方程式进行计算、物质的量浓度的计算,正确书写方程式、明确物质的量浓度的概念及表达式是解本题关键,再结合物质之间的关系式进行解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是( )
| A. | ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O | |
| B. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 | |
| C. | 钠为银白色推知碱金属都是银白色 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
7.近期我国合成多种元素的新同位素,其中一种是${\;}_{72}^{185}$Hf(铪),它的中子数和电子数之差是( )
| A. | 41 | B. | 72 | C. | 113 | D. | 185 |
4.下列说法正确的是( )
| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,在含Cl-、CrO42-浓度相同的溶液中逐滴滴加稀AgNO3溶液时,则先生成AgCl沉淀 | |
| C. | 某晶体中,有金属阳离子一定有阴离子 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
11.下列热化学方程式中的△H能表示对应可燃物质燃烧热的是( )
| A. | 2 CO(g)+O2(g)═2 CO2(g);△H=-566 KJ•mol-1 | |
| B. | CH4(g)+2 O2(g)═CO2(g)+2 H2O(l);△H=-890 KJ•mol-1 | |
| C. | H2 (g)+F2 (g)→2HF(g),△H=-270kJ•mol-1 | |
| D. | 250℃和1.01×105Pa时,反应4NO2(g)+O2(g)═2N2O5(g);△H=-56.76kJ/mol |
8.在用RCl2固体配制溶液时,为了得到澄清溶液并防止变质,常向溶液中加入少量R的单质和盐酸.已知R2+有5个电子层,其最外层有2个电子,则下列推断正确的是( )
| A. | R为ⅡA族元素 | B. | R(OH)4是强碱 | ||
| C. | RCl2有还原性,容易被氧化 | D. | R2+的硝酸盐溶液呈中性 |
8.某工业含锰酸性废水的主要成分为MnSO4,另外还存在Fe2+、Fe3+、Al3+等离子.现以该废水为原料,制备高纯的碳酸锰,工业流程如下:
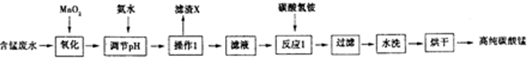
(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
依据表中数据判断,用氨水调节溶液的pH应至5.2.
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.

(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.
 ;
;