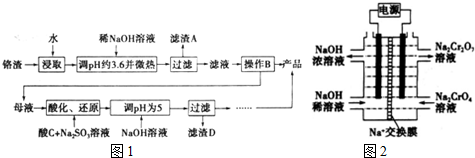
题目内容
14.观察下列模型并结合有关信息,判断有关说法不正确的是( )| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构模型示意图 |  |  |  |  |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A. | 单质B结构单元中含有30个B-B键,含20个正三角形 | |
| B. | SF6是由极性键构成的非极性分子 | |
| C. | 固态硫S8中S原子为sp2杂化 | |
| D. | HCN的结构式为H-C≡N |
分析 A.根据图B12结构单元解题,每个B原子具有$\frac{1}{2}$×5个共价键,每个三角形中含有$\frac{1}{2}$×3个共价键;
B.SF6空间构型为对称结构,分子极性抵消;
C.根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型;
D.碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,原子半径的关系为C>N>H.
解答 解:A.由图知,每个B原子具有$\frac{1}{2}$×5个共价键,12个B原子共含有12×$\frac{1}{2}$×5=30个共价键,含有的三角形数目=30÷($\frac{1}{2}$×3)=20,所以共含有30个B-B键,含20个正三角形,故A正确;
B.不同原子构成的共价键是极性键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子,SF6空间构型为对称结构,分子极性抵消,SF6为非极性分子,故B正确;
C.S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,原子杂化轨道数=δ键数+孤对电子对数=2+$\frac{6-2×1}{2}$=4,所以S是sp3杂化,故C错误;
D.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,则结构式为H-C≡N,故D正确.
故选C.
点评 本题考查微粒的结构示意图,涉及比例、球棍模型、电子式、结构式等,解题的关键是把握各原子间的成键情况,题目难度中等.

练习册系列答案
相关题目
5.在 Na2CO3溶液中,下列离子浓度关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | D. | c(H+)+c(HCO3-)+2 c(H2CO3)=c(OH-) |
2.一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志( )
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2 | |
| D. | 单位时间里每增加1 mol N2,同时增加3 mol H2 |
19.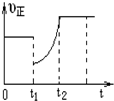 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
 某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
某温度下,将等物质的量A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(g)△H<0.当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A 和0.5n mol B,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A 和n mol B,A、B的转化率均不变 | |
| D. | 图象中表示该反应的正反应速率随时间的变化情况,t1时刻可能是减少了A的浓度,增加了C的浓度 |
6.下列说法正确的是( )
| A. | 第二周期元素的第一电离能随原子序数递增依次增大 | |
| B. | CH2=CH2分子中共有四个σ键和一个π键 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | 电负性:S>P |
4.下列说法正确的是( )
| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,在含Cl-、CrO42-浓度相同的溶液中逐滴滴加稀AgNO3溶液时,则先生成AgCl沉淀 | |
| C. | 某晶体中,有金属阳离子一定有阴离子 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |