题目内容
15.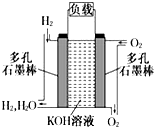 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:(1)写出碱性条件下,氢氧燃料电池工作时正极电极反应方程式:2H2O+O2+4e-=4OH-,
负极的电极反应式:H2+2OH--2e-═2H2O
(2)如果该氢氧燃料为酸性时,正极的电极反应式:CH4+10OH--8e-=CO32-+7H2O负极的电极反应式:CH4+2O2+2OH-=CO32-+3H2O.
分析 在燃料电池中,负极上是燃料发生失电子的氧化反应,正极上发生得电子的还原反应,结合电解质环境来书写电极反应式即可.
解答 解:(1)在氢氧燃料电池中,通入氢气的电极是负极,通入氧气的电极是正极,碱性环境下工作时正极电极反应方程式:2H2O+O2+4e-=4OH-;负极反应为:H2+2OH--2e-═2H2O,
故答案为:2H2O+O2+4e-=4OH-;H2+2OH--2e-═2H2O;
(2)甲烷和氧气燃料电池进行工作时,则通入甲烷的电极为负极,负极反应式为CH4+10OH--8e-=CO32-+7H2O;正极的电极反应式是:2H2O+O2+4e-=4OH-,
故答案为:CH4+10OH--8e-=CO32-+7H2O;CH4+2O2+2OH-=CO32-+3H2O.
点评 本题考查氢氧燃料电池、甲烷燃料电池的电极反应式、总方程式及相互气体的物质的量的知识,难度不大.

练习册系列答案
相关题目
5.在 Na2CO3溶液中,下列离子浓度关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | D. | c(H+)+c(HCO3-)+2 c(H2CO3)=c(OH-) |
6.下列说法正确的是( )
| A. | 第二周期元素的第一电离能随原子序数递增依次增大 | |
| B. | CH2=CH2分子中共有四个σ键和一个π键 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | 电负性:S>P |
10.“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是( )
| A. | ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O | |
| B. | 第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 | |
| C. | 钠为银白色推知碱金属都是银白色 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
7.近期我国合成多种元素的新同位素,其中一种是${\;}_{72}^{185}$Hf(铪),它的中子数和电子数之差是( )
| A. | 41 | B. | 72 | C. | 113 | D. | 185 |
4.下列说法正确的是( )
| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,在含Cl-、CrO42-浓度相同的溶液中逐滴滴加稀AgNO3溶液时,则先生成AgCl沉淀 | |
| C. | 某晶体中,有金属阳离子一定有阴离子 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
5.下列反应可以使碳链增长的是( )
| A. | CH3CH2CH2CH2Br和NaCN共热 | |
| B. | CH3CH2CH2CH2Br和NaOH的乙醇溶液共热 | |
| C. | CH3CH2CH2CH2Br和NaOH的水溶液共热 | |
| D. | CH3CH2CH2CH2Br(g)和Br2(g)光照 |




 .
.