题目内容
15.下列反应的离子方程式正确的是( )| A. | 过氧化钠固体与水反应制氧气:2O22-+2H2O=4OH-+O2↑ | |
| B. | 在100ml浓度为1 mol•L-1 的Fe(NO3)3的溶液中通入足量SO22Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 1mo•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+=Al(OH)3↓+Al3++H2 O | |
| D. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+═HCO3- |
分析 A.过氧化钠为氧化物,离子方程式中应该保留化学式;
B.二氧化硫足量,硝酸根离子在酸性溶液中能够氧化二氧化硫,漏掉了硝酸根离子与二氧化硫的反应;
C.偏铝酸根离子与1mol/L的氢离子反应生成氢氧化铝沉淀,剩余的氢离子与氢氧化铝反应生成铝离子,反应产物中氢氧化铝和铝离子的物质的量相等;
D.醋酸为弱酸,离子方程式中醋酸不能拆开,需要保留分子式.
解答 解:A.过氧化钠应该写成化学式,正确的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2 ↑,故A错误;
B.Fe(NO3)3的溶液中通入足量SO2,硝酸根离子也参与反应,正确的离子反应为:3NO3-+Fe3++5SO2+4H2O═Fe2++5SO42-+3NO↑+8H+,故B错误;
C.1mo•L-1的NaAlO2溶液和2.5mol•L-1的盐酸等体积混合,设溶液体积为1L,则偏铝酸钠为1mol,氯化氢为2.5mol,1mol偏铝酸钠与1mol氢离子反应生成1mol氢氧化铝沉淀,剩余的1.5mol氢离子能够溶解0.5mol氢氧化铝,所以二者恰好反应生成等物质的量的氢氧化铝和铝离子,反应的离子方程式为:2AlO2-+5H+=Al(OH)3↓+Al3++H2O,故C正确;
D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸,反应生成醋酸钠和碳酸氢钠,醋酸不能拆开,正确的离子方程式为:CH3COOH+CO32-═CH3COO-+HCO3-,故D错误;
故选C.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| X | ||
| Y | Z | R |
| W |
| A. | Z的氧化物与X单质不可能发生置换反应 | |
| B. | 五种元素的原子最外层电子数一定都大于2 | |
| C. | X、Z原子序数可能相差18 | |
| D. | Z可能是氯元素 |
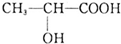 ,下列有关乳酸的说法中,不正确的是( )
,下列有关乳酸的说法中,不正确的是( )| A. | 乳酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol乳酸可与2 mol NaOH发生中和反应 | |
| C. | 1 mol乳酸与足量金属Na反应生成1 mol H2 | |
| D. | 有机物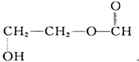 与乳酸互为同分异构体 与乳酸互为同分异构体 |

下列有关说法正确的是( )
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
| A. | Cl- | B. | Al3+ | C. | H+ | D. | OH- |
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有C=C键的数目为3 NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 1 mol FeI2与足量氯气反应时转移的电子数为2 NA |
 .
.
 .
. 的六元环结构,六元环上只有一个取代基
的六元环结构,六元环上只有一个取代基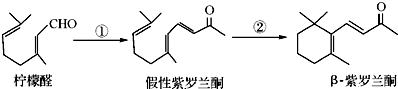
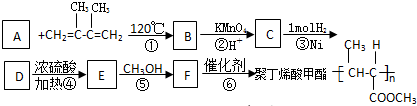
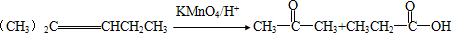

 ;D
;D