题目内容
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_______________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
(ClO2-)。2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。

当pH≤2.0时,ClO2-也能被I-还原成Cl-。
反应生成的I2用标准Na2S2O3溶液滴定: Na2S2O3+I2=Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式______________________。
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:______________________。
步骤6:再用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水样中ClO2-浓度为_____________mol·L-1用含字母的代数式表示)
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,该反应的氧化产物是___________(填化学式)。
【答案】方法二制备的ClO2中不含Cl2 ClO2-+4H++4I-=Cl-+2I2+2H2O 调节溶液的pH≤2.0 ![]() Fe(OH)3
Fe(OH)3
【解析】
(1)更适合用于饮用水的消毒从是否产生污染判断;
(2)①根据题意ClO2-与I-反应在酸性条件进行,产物为I2和Cl-,根据质量守恒可写出离子方程式;
②题目信息提示用的是连续碘量法进行测定,步骤6又用Na2S2O3溶液滴定至终点,说明步骤5中有碘生成,结合pH≤2.0时,ClO2-与I-反应的离子方程式可判断出调节溶液的pH≤2.0;
③求饮用水样中的ClO2-的浓度可以用关系式法以碘单质为桥梁正确的找准ClO2-与Na2S2O3的关系;
④Fe2+将ClO2-还原成Cl-,Fe2+被氧化为铁离子,结合反应物不难得出答案。
(1)根据两种方法中的反应方程式可以看出,方法一制得的ClO2中含有Cl2,会产生对人体有潜在危害的有机氯代物,而方法二制备的ClO2中不含有Cl2,所以 用方法二制备的ClO2更适合用于饮用水的消毒。
(2)①pH≤2.0时,溶液显酸性,所以ClO2-与I-反应的离子方程式为:ClO2-+4H++4I-=Cl-+2I2+2H2O
②根据曲线图示在pH≤2.0时, ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量。
③由 2ClO2+2I-→2ClO2-+I2和Na2S2O3+I2=Na2S4O6+2NaI得: 2ClO2- ~ Na2S2O3
n(ClO2-) = 2 c×![]() ;
;
由ClO2-+4H++4I-=Cl-+2I2+2H2O 和Na2S2O3+I2=Na2S4O6+2NaI得: ClO2-~ 2Na2S2O3
n(ClO2-)总= ![]() ;
;
原水样中ClO2-浓度=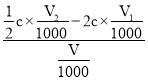 mol/L=
mol/L=![]() mol/L;
mol/L;
④根据反应:4Fe2++ClO2-+2H2O→4Fe3++Cl-+4OH-,Fe3++ OH-→Fe(OH)3所以氧化产物为Fe(OH)3。

【题目】某化学兴趣小组对加碘食盐中的KIO3进行研究,它是一种白色粉末,常温下很稳定。在酸性条件下KIO3是一种较强的氧化剂,与HI、H2O2等作用,被还原为碘单质。 学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取mg加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;发生反应:IO3﹣+5I﹣+6H+=3I2+3H2O,将反应后的溶液加水稀释至100.00 mL。
c.取10.00mL上述溶液到锥形瓶中,以淀粉为指示剂,用物质的量浓度为3.0molL﹣1的 Na2S2O3溶液滴定(滴定时的反应方程式:I2+2S2O32﹣═2I﹣+S4O62﹣)。
d.重复实验2次,三次实验分别记录有关数据如下:
滴定次数 | 待测溶液的体积/mL | 1.00×10﹣3molL﹣1的 Na2S2O3溶液的体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 10.00 | 2.62 | 22.60 |
第二次 | 10.00 | 7.56 | 30.30 |
第三次 | 10.00 | 6.22 | 26.24 |
试回答:
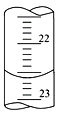
(1)如下图,是某次滴定时的滴定管中的液面,其读数为___________mL。
(2)判断到达滴定终点的现象是:_______________________。
(3)滴定时,Na2S2O3溶液应放在______________ (填“酸式滴定管”或“碱式滴定管”)。
(4)根据实验测定数据,计算加碘食盐样品中的碘元素百分含量是_______(以含m的代数式表示)。
(5)根据上述实验对下列假定情况进行讨论,导致测出待测液的浓度是(填“偏小”、“偏大”或“无影响”)
①标准液读数时,若滴定前俯视,滴定后仰视,测出待测液的浓度__________
②盛标准液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失,测出待测液的浓度___