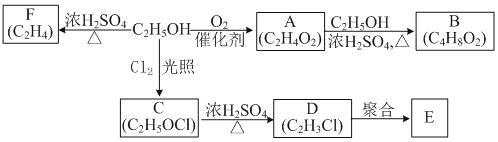
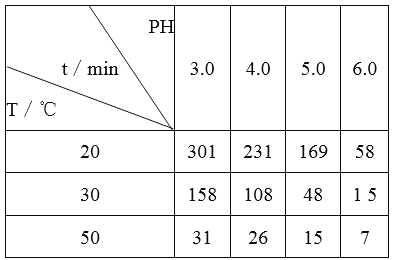
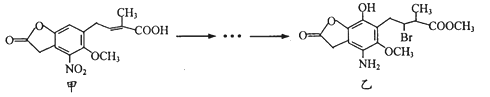
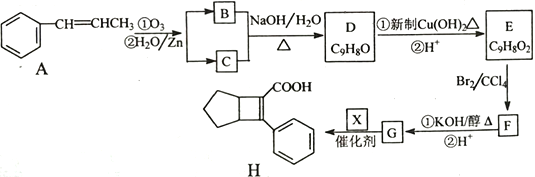
题目内容
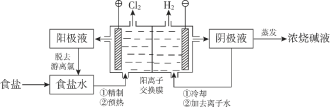
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:
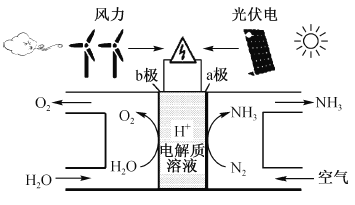
下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
【答案】B
【解析】
A.能量转化方式有:风力→机械能→电能;光能→电能;电能→化学能,故A错误;
B.由图示a极上空气中的N2还原为NH3,a极发生的电极反应为N2+6H+ +6e- = 2NH3,故B正确;
C.H+向阴极(a极)移动,整个电解质溶液的pH不变,故C错误;
D.电解总反应为2N2+ 6H2O = 4NH3 + 3O2,a极区与b极区产生的气体的物质的量之比为4:3,故D错误;
故答案为B。

【题目】三氯化氮(NCl3)是一种消毒剂,可利用氯气与氯化铵溶液反应来制备。已知:三氯化氮的相关性质如下:
物理性质 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为 71℃,不溶于冷水、易溶于有机溶剂,密度为 1.65 gcm-3 | 95℃时爆炸,热水中发生水解 |
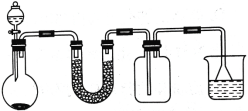
某小组同学选择下列装置(或仪器)设计实验制备三氯化氮并探究其性质:
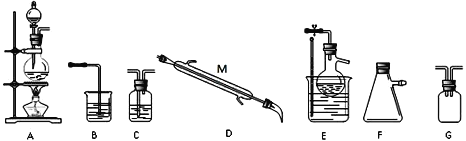
(1)NCl3的电子式为__________________;仪器 M 的名称是______________;
(2)如果气流的方向从左至右,装置连接顺序为A、G、_____________、B。(注明:F仪器使用单孔橡胶塞)
(3)C中试剂是_________________;B装置的作用是________________;
(4)写出E装置中发生反应的化学方程式_______________________________________
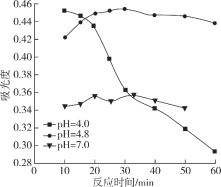
(5)当E装置的烧瓶中出现较多油状液体时停止反应。控制水浴加热温度为__________;
(6)已知三氯化氮不具有漂白性,三氯化氮与热水反应的化学方程式为NCl3+4H2O=NH3H2O+3HClO,请设计实验证明该水解反应的产物______________