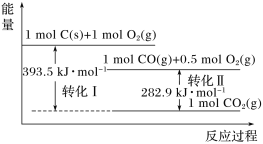
题目内容
【题目】下列离子方程式书写正确的是( )
A.用Cu片作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用两个铜片作电极电解AgNO3溶液:Cu+2Ag+![]() 2Ag+Cu2+
2Ag+Cu2+
C.用石墨作电极电解FeCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用石墨作电极电解CuBr2溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
【答案】B
【解析】
A. 用Cu片作阳极电解饱和食盐水:阳极Cu失电子生成Cu2+,而不是Cl-失电子,A错误;
B. 用两个铜片作电极电解AgNO3溶液:阳极Cu失电子,溶液中的Ag+在阴极得电子,B正确;
C. 用石墨作电极电解FeCl3溶液:阳极Cl-失电子,阴极Fe3+得电子,而不是水电离出的H+得电子,C错误;
D. 用石墨作电极电解CuBr2溶液:阳极Br-失电子,阴极Cu2+得电子,D错误。
故选B。

【题目】I.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表,回答下列问题:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___K。
II.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___。
(2)反应前A的物质的量浓度是___。
(3)10s末,生成物D的浓度为____。