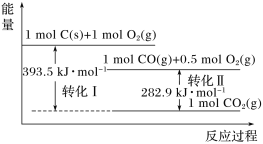
��Ŀ����
����Ŀ��ij��ѧ��ȤС��Լӵ�ʳ���е�KIO3�����о�������һ�ְ�ɫ��ĩ�������º��ȶ���������������KIO3��һ�ֽ�ǿ������������HI��H2O2�����ã�����ԭΪ�ⵥ�ʡ� ѧ�������ʵ�����ӵ�ʳ���е�Ԫ�صĺ������������£�
a����ȡmg�ӵ��Σ�����������ˮ�ܽ⣻
b����ϡ�����ữ���ټ������KI��Һ��������Ӧ��IO3��+5I��+6H+=3I2+3H2O������Ӧ�����Һ��ˮϡ����100.00 mL��
c��ȡ10.00mL������Һ����ƿ�У��Ե���Ϊָʾ���������ʵ���Ũ��Ϊ3.0molL��1�� Na2S2O3��Һ�ζ�(�ζ�ʱ�ķ�Ӧ����ʽ��I2+2S2O32���T2I��+S4O62��)��
d���ظ�ʵ��2�Σ�����ʵ��ֱ��¼�й��������£�
�ζ����� | ������Һ�����/mL | 1.00��10��3molL��1�� Na2S2O3��Һ�����(mL) | |
�ζ�ǰ�̶� | �ζ���̶� | ||
��һ�� | 10.00 | 2.62 | 22.60 |
�ڶ��� | 10.00 | 7.56 | 30.30 |
������ | 10.00 | 6.22 | 26.24 |
�Իش�
��1������ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ___________mL��
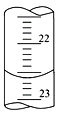
��2���жϵ���ζ��յ�������ǣ�_______________________��
��3���ζ�ʱ��Na2S2O3��ҺӦ����______________ (������ʽ�ζ�����������ʽ�ζ�����)��
��4������ʵ��ⶨ���ݣ�����ӵ�ʳ����Ʒ�еĵ�Ԫ�ذٷֺ�����_______(�Ժ�m�Ĵ���ʽ��ʾ)��
��5����������ʵ������мٶ������������,���²������Һ��Ũ����(����ƫС������ƫ����������Ӱ����)
�ٱ�Һ����ʱ�����ζ�ǰ���ӣ��ζ������ӣ��������Һ��Ũ��__________
��ʢ��Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ���������Һ��Ũ��___
���𰸡�22.60mL ��Һ����ɫ����ɫ���Ұ�����ڲ��ָ� ��ʽ�ζ��� ![]() ƫ�� ƫ��
ƫ�� ƫ��
��������
(1)�����ݵζ��ܾ�ȷ��0.01mL������
(2)����������ˮ������жϣ�Na2S2O3Ϊǿ�������Σ�
(3)���ⵥ������������ɫ�����ⵥ��������ɫ��ȥ��
(4)�����ݷ�Ӧ�ҳ���Ӧ��ϵʽ��Ȼ������������ݼ�����ӵ�ʳ����Ʒ�еĵ�Ԫ�غ�����
(5)������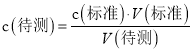 ������
������
(1)���ζ�����Һ�����Ϊ22.60mL��
�ʴ�Ϊ22.60mL��
(2)��b������I2 ��c��ʹ�õ�����Ϊָʾ�������������Һ����ɫ����Na2S2O3��Һ�ζ�, I2��Ӧ��ϣ���Һ��ɫ��ɫ���ζ��յ�����Ϊ����ɫ����ɫ���Ұ�����ڲ��ָ���
�ʴ�Ϊ��Һ��ɫ����ɫ���Ұ�����ڲ��ָ���
(3)��Na2S2O3Ϊǿ��������,��Ϊ������������ˮ�⣬Na2S2O3��Һ�������ԣ����Եζ�ʱNa2S2O3��ҺӦ���ڼ��Եζ����У�
�ʴ�Ϊ��ʽ�ζ��ܣ�
(4)�����ݱ����֪�����εζ����ĵ�Na2S2O3����ֱ�Ϊ��19.98mL��22.74mL��20.02mL���ڶ�������������ϴ�Ӧ��ȥ����������Na2S2O3��Һ���Ϊ20mL������Na2S2O3�����ʵ���Ϊ3.00mol/L��0.02L = 0.06mol ������IO3��+5I��+6H+=3I2+3H2O��I2+2S2O32���T2I��+S4O62������IO3��~3I2~6 S2O32��������10mL��Һ�е���ص����ʵ���Ϊ0.01mol����100ml��Һ�е����ʵ���Ϊ0.1mol����Ԫ�ص�����Ϊ��0.1mol��127g/mol=12.7g�����Լӵ�ʳ����Ʒ�еĵ�Ԫ�غ���Ϊ![]() ��
��
�ʴ�Ϊ![]() ��
��
(5) �١����ζ�ǰ������ҺҺ�棬�ζ�������Һ��̶ȣ���ȡ����Һ���ƫ����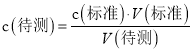 ������֪�ⶨ���ƫ��
������֪�ⶨ���ƫ��
�ڡ�ʢ��Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ������Һ���ƫ����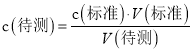 ������֪�������Һ��Ũ��ƫ��
������֪�������Һ��Ũ��ƫ��
�ʴ�Ϊƫ��ƫ��

����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ��K | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��1���������ֵ���ʵ�������ǿ����˳��Ϊ__________________(�û�ѧʽ��ʾ����ͬ)��
��2�������£�0.02 mol��L��1��CH3COOH��Һ�ĵ����ԼΪ______�����Ϊ10mLpH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��________����(������������=��)��
��3����֪NaHSO3��Һ�����ԣ���ԭ����____________(���ӷ���ʽ���ʵ���������)��
��4��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ_______________________��