题目内容
13.能够证明甲烷分子空间结构为正四面体的事实是( )| A. | 碳氢键的键能相等 | B. | 甲烷的二氯代物的结构只一种 | ||
| C. | 四个碳氢键的键长相等 | D. | 甲烷的一氯代物只有一种 |
分析 A.若是平面正方形结构,甲烷的4个碳氢键的键长、键能也相等;
B.如果甲烷是正方形的平面结构,而CH2Cl2有两种结构:相邻或者对角线上的氢被Cl取代,而实际上,其二氯取代物只有一种结构,因此只有正四面体结构才符合;
C.甲烷如果是平面结构,甲烷的4个碳氢键的键长也相等;
D.甲烷若是平面结构,甲烷中的四个氢原子位置也相同.
解答 解:A.由于甲烷为平面正方形结构时,甲烷的4个碳氢键的键能也相等,所以无法判断甲烷为正四面体结构,故A错误;
B.若为平面正方形结构,二氯甲烷有两种同分异构体,而正四面体的二氯甲烷不存在同分异构体,故B正确;
C.甲烷无论是正四面体结构,还是正方形,甲烷的4个碳氢键的键长都相等,无法判断甲烷的结构,故C错误;
D.甲烷无论是正四面体结构,还是正方形,其一氯代物只有1种,不能说明分子结构,故D错误;故选B.
点评 本题考查甲烷的分子结构,题目难度不大,注意掌握常见有机物的结构与性质,明确二氯甲烷没有同分异构体说明甲烷是正四面体结构.

练习册系列答案
相关题目
3.以下实验或操作不能达到目的是( )
| A. | 用铜片(必要时可加热)鉴别浓硝酸、稀硝酸、浓硫酸和浓盐酸 | |
| B. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| C. | 用酸式滴定管量取8.00mL1mol/L的KMnO4溶液 | |
| D. | 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,必须重新配制 |
4.由两种短周期元素构成的某常见离子化合物,阴、阳离子所含的电子数不同,关于该离子化合物的下列说法正确的是( )
| A. | 晶体中阴、阳离子的数目之比一定是1:1 | |
| B. | 晶体内一定只有离子键没有共价键 | |
| C. | 两元素可以在同一周期也可在不同周期 | |
| D. | 阴离子的电子数一定小于阳离子的电子数 |
1.同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列说法中,正确的是( )
| A. | 原子半径:X>Y>Z | B. | 非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:ZH3>H2Y>HX | D. | 原子序数:Z>Y>X |
8.取1 mol A和a mol B使其发生反应 A(g)+aB(g)?bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的$\frac{4}{3}$倍,则a、b可能是( )
| A. | a=1,b=4 | B. | a=3,b=3 | C. | a=2,b=3 | D. | a=3,b=2 |
18.化学是一门以实验为基础的学科,化学研究离不开化学实验,下列有关化学实验的说法正确的是( )
| A. | 实验室制取乙烯时用酒精灯加热,使反应体系的温度迅速上升到170℃是为了加快反应速率 | |
| B. | 提纯苯甲酸的实验中,粗苯甲酸全部溶解后不用再向烧杯中加入少量蒸馏水 | |
| C. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞作指示剂比选用甲基橙作指示剂时带来的误差要小一些 | |
| D. | 要检验某混合气体中含有乙烯,可以将气体直接通入到酸性高锰酸钾溶液中,若紫色褪去,则说明含有乙烯 |
2.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向2 mL 0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液;再加入几滴0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |
3.有机物的结构可用“键线式”简化表示,如CH3-CH=CH-CH3可简写为 .有机物X的键线式为
.有机物X的键线式为 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
 .有机物X的键线式为
.有机物X的键线式为 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为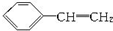 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |