题目内容
12.为了测定某仅含碳、氢、氧三种元素组成的有机化合物的结构,进行了如下实验.首先取该有机化合物样品4.6g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重5.4g和8.8g;然后用质谱仪测定其相对分子质量,经测定得到如图1所示的质谱图;最后用核磁共振仪处理该有机物,得到如图2所示的核磁共振氢谱图.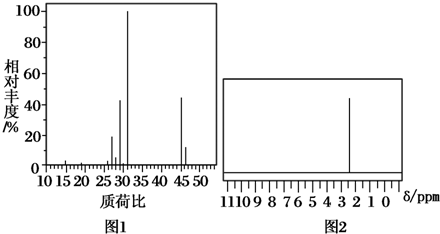
试回答下列问题:
(1)该有机化合物的相对分子质量为46;
(2)该有机物的实验式为C2H6O;
(3)能否根据该有机物的实验式确定其分子式能(填“能”或“不能”),原因是因为实验式为C2H6O的有机物相对分子质量为46,所以实验式即为分子式,该有机化合物的分子式为C2H6O.
(4)请写出该有机化合物的结构简式CH3OCH3 .
分析 浓硫酸吸收的是水,碱石灰吸收的是二氧化碳,4.6g的该有机物的物质的量=$\frac{4.6g}{46g/mol}$,水的物质的量=$\frac{5.4g}{18g/mol}$,二氧化碳的物质的量=$\frac{8.8g}{44g/mol}$,所以有机物、二氧化碳和水的物质的量之比=0.1mol:0.2mol:0.3mol=1:2:3,所以该有机物分子中含有2个碳原子、6个氢原子,该有机物的相对分子质量是46,所以该分子中还含有1个氧原子,其化学式为C2H6O,核磁共振氢谱中,氢原子种类和吸收峰个数相等,据此确定该有机物的结构简式.
解答 解:(1)由图1所示的质谱图,可知该有机化合物的相对分子质量为46,故答案为:46;
(2)该有机化合物的相对分子质量为浓硫酸吸收的是水,碱石灰吸收的是二氧化碳,4.6g的该有机物的物质的量=$\frac{4.6g}{46g/mol}$,水的物质的量=$\frac{5.4g}{18g/mol}$,二氧化碳的物质的量=$\frac{8.8g}{44g/mol}$,所以有机物、二氧化碳和水的物质的量之比=0.1mol:0.2mol:0.3mol=1:2:3,所以该有机物分子中含有2个碳原子、6个氢原子,该有机物的相对分子质量是46,所以该分子中还含有1个氧原子,其化学式为C2H6O,故答案为:C2H6O;
(3)由于实验式为C2H6O的有机物相对分子质量为46,所以实验式即为分子式,
故答案为:能;因为实验式为C2H6O的有机物相对分子质量为46,所以实验式即为分子式;C2H6O;
(4)核磁共振氢谱中,氢原子种类和吸收峰个数相等,该图片中只有一个吸收峰,说明该有机物中只含一种类型的氢原子,结合其分子式知,该有机物的是甲醚,其结构简式为:CH3OCH3 ,故答案为:CH3OCH3 .
点评 本题考查了有机物分子式的确定,明确浓硫酸和碱石灰吸收的物质及各物质物质的量之间的关系是解本题关键,难度不大.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案| X | |
| Y | Z |
| A. | X、Y、Z可以都是金属 | |
| B. | 原子半径:Z>Y>X | |
| C. | 最高价氧化物对应的水化物酸性:Z>Y>X | |
| D. | 若X、Y、Z可形成  分子,则其中各原子都满足8电子结构 分子,则其中各原子都满足8电子结构 |
| A. | 用铜片(必要时可加热)鉴别浓硝酸、稀硝酸、浓硫酸和浓盐酸 | |
| B. | 将氯化铝溶液加热蒸发、烘干可得无水氯化铝固体 | |
| C. | 用酸式滴定管量取8.00mL1mol/L的KMnO4溶液 | |
| D. | 配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,必须重新配制 |
| A. | 1392m3 | B. | 1740m3 | C. | 1920m3 | D. | 2304m3 |
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
| A. | 晶体中阴、阳离子的数目之比一定是1:1 | |
| B. | 晶体内一定只有离子键没有共价键 | |
| C. | 两元素可以在同一周期也可在不同周期 | |
| D. | 阴离子的电子数一定小于阳离子的电子数 |
| A. | 原子半径:X>Y>Z | B. | 非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:ZH3>H2Y>HX | D. | 原子序数:Z>Y>X |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向2 mL 0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液;再加入几滴0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |