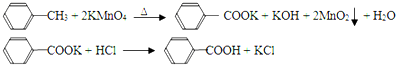
题目内容
9.1932年美国化学家鲍林首先提出了电负性的概念.电负性(用X表示)也是元素的一种重要性质,若 x 越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的 x 值:| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x 值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
2.55<x (N)<3.44,0.93<x (Mg)<1.57.
(2)某有机化合物结构中含S-N键,其共用电子对偏向氮(写原子名称).
(3)经验规律告诉我们:当成键的两原子相应元素的 x 差值△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键类型是共价键.
(4)预测周期表中,x值最小的元素位于六周期IA族.(放射性元素除外)
分析 (1)分析表中数据,找出元素的电负性递变规律,据此解答;
(2)硫的电负性弱于氮,得电子能力弱于氮;
(3)依据图中数据计算Al、Br的△x值进行解答;
(4)根据电负性的递变规律判断.
解答 解:(1)由表中数值可看出,同周期中元素的x值随原子半径的减小而增大,同主族自上而下x值减小,x值的变化体现周期性的变化,同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,故2.55<x(N)<3.44,0.93<x(Mg)<1.57;
故答案为:2.55;3.44;0.93;1.57;
(2)硫的电负性弱于氮,得电子能力弱于氮,所以S-N键,其共用电子对偏向氮,故答案为:氮;
(3)AlBr3中,Al元素的电负性为1.61,Br元素的电负性小于3.16,则二者差值小于1.7,AlBr3中化学键类型为共价键,
故答案为:共价键;
(4)同一周期周期从左到右,元素的电负性逐渐增大,同一主族从上到下,元素的电负性逐渐减小,则电负性最小的元素应位于周期表的左下角,排除放射性元素,应为Cs元素,位于第六周期IA族,故答案为:六;IA.
点评 本题考查电负性的递变规律,依据图中数据总结元素电负性递变规律即可解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.冶铁的原料为铁矿石、焦炭、空气和石灰石.测得某冶铁高炉煤气的体积分数为CO-0.28;CO2-0.10; N2-0.58,棕色烟尘-0.04(不含氮元素).若每生产1000kg生铁排放煤气2400m3,则至少需要补充空气?(空气体积分数:氮气0.8 氧气0.2),气体都在同温同压下测定.( )
| A. | 1392m3 | B. | 1740m3 | C. | 1920m3 | D. | 2304m3 |
17.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
4.由两种短周期元素构成的某常见离子化合物,阴、阳离子所含的电子数不同,关于该离子化合物的下列说法正确的是( )
| A. | 晶体中阴、阳离子的数目之比一定是1:1 | |
| B. | 晶体内一定只有离子键没有共价键 | |
| C. | 两元素可以在同一周期也可在不同周期 | |
| D. | 阴离子的电子数一定小于阳离子的电子数 |
1.同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列说法中,正确的是( )
| A. | 原子半径:X>Y>Z | B. | 非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:ZH3>H2Y>HX | D. | 原子序数:Z>Y>X |
18.化学是一门以实验为基础的学科,化学研究离不开化学实验,下列有关化学实验的说法正确的是( )
| A. | 实验室制取乙烯时用酒精灯加热,使反应体系的温度迅速上升到170℃是为了加快反应速率 | |
| B. | 提纯苯甲酸的实验中,粗苯甲酸全部溶解后不用再向烧杯中加入少量蒸馏水 | |
| C. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞作指示剂比选用甲基橙作指示剂时带来的误差要小一些 | |
| D. | 要检验某混合气体中含有乙烯,可以将气体直接通入到酸性高锰酸钾溶液中,若紫色褪去,则说明含有乙烯 |
19.下列各种观点正确的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲苯中含有碳碳双键 | |
| B. | 乙烯能发生加成反应,因而乙烯能在一定条件下聚合生成高分子化合物 | |
| C. | 有机物的水溶液一定不能导电 | |
| D. | 通常情况下呈气态的烃含有的碳原子一定不多于四个 |