题目内容
16.下表所列各组第I栏中的化学反应与第Ⅱ栏中的化学反应都可以用第Ⅲ栏中的离子方程式表示的是( )| 选项 | 第I栏 | 第Ⅱ栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中投入铝片 | Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B | 往Fe2(SO4)3溶液中滴入氢氧化钠溶液 | 往Fe2(SO4)3溶液中滴入氢氧化钡溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | NaHCO3溶液滴入Ca(OH)2溶液 | NaHCO3溶液滴入NaOH溶液 | OH-+HCO3-═CO32-+H2O |
| D | 往NaOH溶液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-═HCO3- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,与反应物的过量情况无关;
B.硫酸铁与氢氧化钡反应除了生成氢氧化铁沉淀,还生成硫酸钡沉淀,二者的离子方程式不同;
C.碳酸氢钠与氢氧化钙生成碳酸钙沉淀,而碳酸氢钠与氢氧化钠反应生成碳酸钠,二者的反应产物不同;
D.二氧化碳过量,反应生成碳酸氢钠,二氧化碳不足,反应生成碳酸钠.
解答 解:A.往少量NaOH溶液中投入铝片、往过量NaOH溶液中投入铝片,反应的离子方程式都是Al+2OH-+2H2O═2AlO2-+3H2↑,故A正确;
B.往Fe2(SO4)3溶液中滴入氢氧化钠溶液,反应的离子方程式为:Fe3++3OH-═Fe(OH)3↓,而往Fe2(SO4)3溶液中滴入氢氧化钡溶液,反应的离子方程式为:3SO42-+3Ba2++2Fe3++6OH-=2Fe(OH)3↓+3BaSO4↓,反应还生成硫酸钡沉淀,二者的离子方程式不同,故B错误;
C.NaHCO3溶液滴入Ca(OH)2溶液,反应的离子方程式为:Ca2++2OH-+HCO3-═CO32-+CaCO3↓+2H2O,NaHCO3溶液滴入NaOH溶液的离子方程式为:OH-+HCO3-═CO32-+H2O,二者的离子方程式不同,故C错误;
D.往NaOH溶液中通入过量CO2气体,反应生成碳酸氢钠,反应的离子方程式为:CO2+OH-═HCO3-,往NaOH溶液中通入少量CO2气体,反应生成碳酸钠,反应的离子方程式为:CO2+2OH-═CO32-+H2O,两个反应的离子方程式不同,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意掌握离子方程式的书写原则,明确反应物过量情况对生成物的影响为解答关键,试题侧重考查学生的分析、理解能力.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
6.已知钫(Fr) 和砹(At)分别是碱金属元素和卤族元素中原子序数最大的元素,关于两者性质的预测,不正确的是( )
| A. | 钫与水反应发生爆炸,生成的氢氧化物FrOH是一种极强的碱 | |
| B. | 钫极易在氧气中燃烧,燃烧生成复杂的氧化物 | |
| C. | 砹单质是有色气体,易溶于CCl4等有机溶剂 | |
| D. | 砹单质不容易与氢气化合 |
7.有8种物质:①乙烷;②乙烯;④苯;⑤甲苯;⑥溴乙烷;⑦聚乙烯;⑧环己烯.其中既不能使酸性KMnO4溶液褪色,也不能与溴水反应而使溴水褪色的是(( )
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
4.由两种短周期元素构成的某常见离子化合物,阴、阳离子所含的电子数不同,关于该离子化合物的下列说法正确的是( )
| A. | 晶体中阴、阳离子的数目之比一定是1:1 | |
| B. | 晶体内一定只有离子键没有共价键 | |
| C. | 两元素可以在同一周期也可在不同周期 | |
| D. | 阴离子的电子数一定小于阳离子的电子数 |
1.同周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列说法中,正确的是( )
| A. | 原子半径:X>Y>Z | B. | 非金属性:X>Y>Z | ||
| C. | 气态氢化物的稳定性:ZH3>H2Y>HX | D. | 原子序数:Z>Y>X |
8.取1 mol A和a mol B使其发生反应 A(g)+aB(g)?bC(g),当反应达到平衡时,A的转化率为50%,在同温、同压下测得混合气体的密度是原来的$\frac{4}{3}$倍,则a、b可能是( )
| A. | a=1,b=4 | B. | a=3,b=3 | C. | a=2,b=3 | D. | a=3,b=2 |
6.以乙醇为原料,用下述6种类型的反应:①氧化;②消去;③加成;④酯化;⑤水解⑥加聚,来合成乙二酸乙二酯(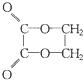 )的正确顺序是( )
)的正确顺序是( )
 )的正确顺序是( )
)的正确顺序是( )| A. | ①⑤②③④ | B. | ①②③④⑤ | C. | ②③⑤①④ | D. | ②③⑤①⑥ |