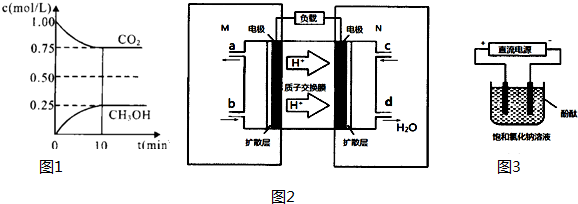
��Ŀ����
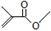
15����֪��ͪ[CH3COCH3]����ʽ�ɱ�ʾΪ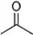 �����ݼ���ʽ�ش��������⣺
�����ݼ���ʽ�ش��������⣺��1��
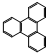
 ����ʽ��C5H9O2���ṹ��ʽ��CH2=CH��CH3��COOCH3��
����ʽ��C5H9O2���ṹ��ʽ��CH2=CH��CH3��COOCH3����2��д����ϩ���ӵĵ���ʽ��
 ��
����3���л��CH3��2CHCH��C2H5��CH=CH2������4-��-3-�һ�-1-��ϩ��
��4��д���ױ���TNT��ѧ����ʽ
 +3HNO3$��_{��}^{Ũ����}$
+3HNO3$��_{��}^{Ũ����}$ +3H2O��
+3H2O����5��
 ��һ��ȡ������2�֣�
��һ��ȡ������2�֣�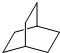 �Ķ���ȡ������7�֣�
�Ķ���ȡ������7�֣�
���� ��1������C�γ�4����ѧ����O�γ�2����ѧ��������
��2����ϩ����2�Թ��õ��Ӷԣ�
��3��������C=C��Ϊϩ����ѡ�������ŵ��̼��Ϊ��������֪������5��C��
��4���ױ���Ũ���ᡢŨ���ᷴӦ����TNT��
��5����ȡ�����������ȡ�����л���������ԭ�ӵ����ࣻ�����е�Ч��ԭ��һ��������������ٷ�����ͬһ�������ӵ���ԭ�ӵ�Ч��
��ͬһ̼ԭ����������ԭ�ӵ�Ч��ͬһ̼ԭ���������ϵ���ԭ�ӵ�Ч���۴��ھ���Գ�λ���ϵ���ԭ�ӵ�Ч���ݴ˷������
��� �⣺��1��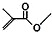 �ķ���ʽΪ��C5H9O2���ṹ��ʽΪCH2=C��CH3��COOCH3���ʴ�Ϊ��C5H9O2��CH2=C��CH3��COOCH3��
�ķ���ʽΪ��C5H9O2���ṹ��ʽΪCH2=C��CH3��COOCH3���ʴ�Ϊ��C5H9O2��CH2=C��CH3��COOCH3��
��2����ϩ�к�̼��̼֮���Թ���˫����ϣ�����ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3���л��CH3��2CHCH��C2H5��CH=CH2��������4-��-3-�һ�-1-��ϩ���ʴ�Ϊ��4-��-3-�һ�-1-��ϩ��
��4���ױ�����ȡ����Ӧ����Ũ���ᡢŨ����Ļ���Ṳ��ʱ����������Ӧ�����������ױ�������ʽΪ +3HNO3$��_{��}^{Ũ����}$
+3HNO3$��_{��}^{Ũ����}$  +3H2O��
+3H2O��
�ʴ�Ϊ�� +3HNO3$��_{��}^{Ũ����}$
+3HNO3$��_{��}^{Ũ����}$  +3H2O��
+3H2O��
��5�� ����2����ԭ�ӣ�����
����2����ԭ�ӣ����� ��һ��ȡ������2�֣�
��һ��ȡ������2�֣� �����к�2��CH��6��CH2����2��λ�õ�H������ȡ��CH��1��Hԭ�ӣ�����һ��ȡ��CH2��λ������һֱ�ߺͲ���һֱ��2�֣�����ȡ��CH2��1��Hԭ�ӣ�����һ��ȡ��CH2��λ���ڡ��䡢�Թ�3�ֽṹ������ȡ������CH��2��Hԭ��ֻ��1�֣�����ȡ��ͬһCH2��2��Hԭ��ֻ��1�֣����Ը����ʵĶ���ȡ������7�֣�
�����к�2��CH��6��CH2����2��λ�õ�H������ȡ��CH��1��Hԭ�ӣ�����һ��ȡ��CH2��λ������һֱ�ߺͲ���һֱ��2�֣�����ȡ��CH2��1��Hԭ�ӣ�����һ��ȡ��CH2��λ���ڡ��䡢�Թ�3�ֽṹ������ȡ������CH��2��Hԭ��ֻ��1�֣�����ȡ��ͬһCH2��2��Hԭ��ֻ��1�֣����Ը����ʵĶ���ȡ������7�֣�
�ʴ�Ϊ��2��7��
���� ���⿼���˵���ʽ����д������ͬϵ���������Ӧ����ʽ��ͬ���칹��Ŀ���ж�����Ŀ�Ѷ��еȣ����ձ�ͬ���칹����д��������ȷ����ʽ�ĸ����дԭ���ǽ����Ĺؼ���ע��ȡ������Ч�ⷨ�����ж�ȡ�����ͬ���칹����õķ�����

| A�� |  | B�� | HC��C-CH3 | ||
| C�� | 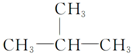 | D�� |  |
| A�� | ����ˮ��Ӧ������ը�����ɵ���������FrOH��һ�ּ�ǿ�ļ� | |
| B�� | �ռ�����������ȼ�գ�ȼ�����ɸ��ӵ������� | |
| C�� | ����������ɫ���壬������CCl4���л��ܼ� | |
| D�� | �����ʲ��������������� |
| A�� | ��ͭƬ����Ҫʱ�ɼ��ȣ�����Ũ���ᡢϡ���ᡢŨ�����Ũ���� | |
| B�� | ���Ȼ�����Һ������������ɿɵ���ˮ�Ȼ������� | |
| C�� | ����ʽ�ζ�����ȡ8.00mL1mol/L��KMnO4��Һ | |
| D�� | ����һ��Ũ�ȵ���Һʱ��������ʱ��С�ļ�ˮ��������ƿ�Ŀ̶��ߣ������������� |
| A�� | ��Ӧ�����������������������ڷ�Ӧ���ɵ�ˮ�������� | |
| B�� | 2 molˮ������������2 mol������1 mol������������ | |
| C�� | ����2 molH-H���Ͷ���1 molO�TO�����յ������������γ�4 molH-O���ų��������� | |
| D�� | ����4 molH-O�����յ������������γ�2 molH-H�����γ�1 molO�TO���ų��������� |
| A�� | 1392m3 | B�� | 1740m3 | C�� | 1920m3 | D�� | 2304m3 |
| A�� | �٢ڢۢ� | B�� | �ܢޢߢ� | C�� | �٢ܢޢ� | D�� | �ڢۢݢ� |
| A�� | ���������������ӵ���Ŀ֮��һ����1��1 | |
| B�� | ������һ��ֻ�����Ӽ�û�й��ۼ� | |
| C�� | ��Ԫ�ؿ�����ͬһ����Ҳ���ڲ�ͬ���� | |
| D�� | �����ӵĵ�����һ��С�������ӵĵ����� |