题目内容
16.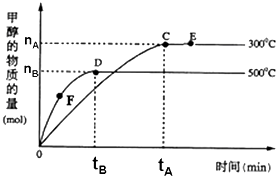 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),根据题意,以下说法正确的是( )| A. | 正反应的△H<0 | |
| B. | 容器中气体的总物质的量E点大于D点 | |
| C. | F点的正反应速率大于逆反应速率 | |
| D. | v(甲醇)=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示500℃时反应在D点的速率 |
分析 A.根据温度对甲醇质量的影响判断平衡移动方向,可判断正反应的△H;
B.根据温度对甲醇质量的影响判断平衡移动方向,可判断气体的总物质的量大小;
C.根据F点时反应向正反应方向移动分析;
D.根据v=$\frac{△c}{△t}$计算的反应速率是指在0到tB内的平均反应速率.
解答 解:A.从图象可知温度高时平衡体系中甲醇含量减少,平衡向逆反应方向移动,所以正反应的△H<0,故A正确;
B.从图象可知温度高时平衡体系中甲醇含量减少,平衡向逆反应方向移动,所以温度越高,气体的总物质的量越大,故D点大于E点,故B错误;
C.由图象分析,F点时反应向正反应方向移动,所以正反应速率大于逆反应速率,故C正确;
D.500℃时,反应开始到平衡,v(甲醇)=$\frac{△c}{△t}$=$\frac{{n}_{B}}{3{t}_{B}}$mol/(L•min)表示0到tB内甲醇的平均反应速率,故D错误.
故选AC.
点评 本题考查化学平衡移动图象问题,题目难度中等,解答该题的关键是把握图象的曲线变化特点,以此判断温度对平衡移动的影响,注意平衡移动原理,很多题目以填空题的形式考查.

练习册系列答案
相关题目
6. 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:
TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.下列有关该反应的说法正确的是( )
 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg$\frac{\underline{\;高温\;}}{\;}$Ti+2MgCl2.下列有关该反应的说法正确的是( )
| A. | TiCl4是还原剂 | B. | Mg被氧化 | ||
| C. | TiCl4发生氧化反应 | D. | Mg得到电子 |
4.将3.2g Cu与足量的浓硫酸在加热条件下充分反应.
(1)被还原的硫酸的物质的量为0.05mol.
(2)把反应后的溶液稀释至500ml,取出50ml,向其中加入足量的BaCl2溶液,得到沉淀20.27g,则稀释后所得溶液中SO42-的物质的量浓度为1.74mol/L(保留两位小数).
(3)若浓硫酸中含溶质为a mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)<0.5amol.
(4)将产生的气体缓慢通入100ml b mol/L的氢氧化钠溶液中,若反应物均无剩余,则b的取值范围为0.5≤b≤1.
(5)讨论b的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中
(1)被还原的硫酸的物质的量为0.05mol.
(2)把反应后的溶液稀释至500ml,取出50ml,向其中加入足量的BaCl2溶液,得到沉淀20.27g,则稀释后所得溶液中SO42-的物质的量浓度为1.74mol/L(保留两位小数).
(3)若浓硫酸中含溶质为a mol,投入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)<0.5amol.
(4)将产生的气体缓慢通入100ml b mol/L的氢氧化钠溶液中,若反应物均无剩余,则b的取值范围为0.5≤b≤1.
(5)讨论b的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中
| b的范围 | 溶质的种类 | 溶质的物质的量(mol) |
| 0.5 | NaHSO3 | 0.05 |
11.下列过程或现象与盐类水解无关的是( )
| A. | 加热蒸干并灼烧FeCl3溶液,得到Fe2O3固体 | |
| B. | 铁在潮湿的环境下生锈 | |
| C. | 明矾净水 | |
| D. | 浓硫化钠溶液有臭味 |
8.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上常采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是上述反应在不同温度下的化学平衡常数(K).
由表中数据判断△H1<0 (填“>”、“=”或“<”).
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
③H2O(g)=H2O(l);△H=-44.0kJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为266.8kJ.
(1)工业上常采用下列反应合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H1
①下表所列数据是上述反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
③H2O(g)=H2O(l);△H=-44.0kJ/mol
请计算1mol甲醇不完全燃烧生成1mol一氧化碳和液态水放出的热量为266.8kJ.
5.下列推断正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应 | |
| B. | NH3的水溶液能导电,说明NH3是电解质 | |
| C. | SO2能使溴水褪色,表现了漂白性 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |

 .
. 哈伯因为氨气的合成曾获1918年诺贝尔奖.
哈伯因为氨气的合成曾获1918年诺贝尔奖.