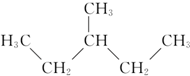
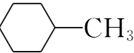
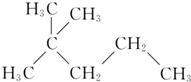
题目内容
9.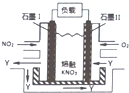 NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )
NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )| A. | NO2在石墨I附近发生氧化反应 | |
| B. | 该电池放电时N03-向石墨I电极迁移 | |
| C. | 石墨Ⅱ附近发生的反应:O2+4e-+2N205=4 N03- | |
| D. | 相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 |
分析 该燃料电池中,负极上通入NO2,正极上通入O2,根据电解质知,负极电极反应式为NO2-e-+NO3-═N2O5,正极电极反应式为O2+2N2O5+4e-═4NO3-,据此分析解答.
解答 解:A.负极上二氧化氮失电子和硝酸根离子反应生成五氧化二氮,在石墨I附近发生氧化反应,故A正确;
B.放电时,电解质中阴离子向负极移动,所以N03-向石墨I电极迁移,故B正确;
C.石墨Ⅱ为正极,电极反应式为O2+2N2O5+4e-═4NO3-,故C正确;
D.由负极电极反应式为NO2-e-+NO3-═N2O5,正极电极反应式为O2+2N2O5+4e-═4NO3-,根据电子守恒,则放电过程中消耗的NO2和O2的体积比4:1,故D错误;
故选D.
点评 本题考查了化学电源新型电池,根据得失电子判断正负极,根据二氧化氮的产物状态判断产物成分,难点是电极反应式的书写,要仔细揣摩,难度中等.

练习册系列答案
相关题目
18.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4LC2H6所含化学键总数为7 NA | |
| C. | 常温常压下,14gC0、N2混合气体所含分子总数为NA | |
| D. | 0.1 mol-1LNH4C1溶液中,NH4+与Cl一数之和小于0.2 NA |
19.下列4个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是( )
| A | B | C | D |
| 向一定量铁粉中滴加稀盐酸 | 向一定量硫酸铜溶液中不断加入锌粉 | 加热一定量高锰酸钾固体 | 向一定量氢氧化钠 溶液中滴加稀盐酸 |
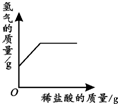 | 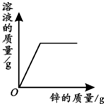 |  | 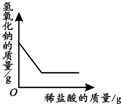 |
| A. | A | B. | B | C. | C | D. | D |
 能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.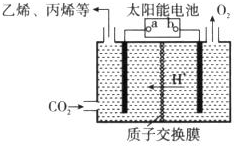

 铜是应用较为广泛的有色金属.
铜是应用较为广泛的有色金属.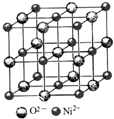 高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.
高氯酸三碳酰肼合镍{[Ni(CHZ)3](ClO4)2 }是一种新型的起爆药.